Сероводород
Содержание:
- Методы очистки нефти от серы
- Химические свойства сероводорода
- Способы обеззараживания воды
- Реактивность и опасности
- Сероводород в естественной среде
- токсикология
- Удаление — сероводород
- Применение сероводорода:
- Концентрация сероводорода в воздухе московского региона не превышает нормы
- Способы очистки воды от сероводорода
- физиология
- Классификация нефти по содержанию серы
Методы очистки нефти от серы
Методы ионной хроматографии с разложением описаны в стандартах: ГОСТ Р 57033, ГОСТ Р 54263, ASTM D 7359, ASTM D7573, ASTM D 5987, UOP 991.
Для обессеривания легких фракций используют щелочную очистку. Способы обработки тяжелых фракций более сложные.
Одним из первых способов обработки был сернокислотный метод, т.е. окисление серосодержащих примесей серной кислотой.
В целом, для удаления серы из нефтяных образцов и нефтепродуктов используют два основных подхода:
-
разрушение сераорганических соединений с последующей очисткой от их продуктов реакции;
-
селективное извлечение сераорганики.
В первом случае очистка выполняется методами, предполагающими использование сорбентов и катализаторов (оксиды или сульфиды кобальта, никеля, железа, молибдена, вольфрама) или микроорганизмов (биодесульфуризация).
Для реализации второго метода применяют окислительное десульфирование и экстракцию.
Химические свойства сероводорода
Растворяясь в воде, сероводород образует слабую двухосновную кислоту, называемую сероводородной водой:
Двухступенчатая диссоциация H2S H++HS- (гидросульфид-ион) HS- H++S2- (сульфид-ион)
Реакции сероводородной воды:
- с основными оксидами образует соли-сульфиды:
H2S + CaO = CaS + H2O
- с основаниями образует сульфиды и гидросульфиды (при избытке H2S):
H2S + NaOH NaHS + H2O H2S + OH- HS- + H2O H2S + 2NaOH Na2S + 2H2O H2S + 2OH- S2- + 2H2O
- с солями образует малорастворимые сульфиды:
CuSO4 + H2S = CuS + H2SO4 Cu2++H2S = CuS↓ + 2H+
- с металлами образует соли-сульфиды:
Ca + H2S = CaS + H2↑
Растворимость в воде:
- гидросульфиды (кислые соли сероводородной кислоты) хорошо растворяются в воде (NaHS, Ca(HS)2);
- сульфиды щелочных и щелочноземельных металлов (нормальные соли), сульфид аммония (NH4)2S — растворимы в воде;
- сульфиды остальных металлов нерастворимы в воде;
- сульфиды меди, свинца, серебра, ртути, других тяжелых металлов нерастворимы ни в воде, ни в кислотах (за исключением азотной кислоты).
Окраска сульфидов:
- PbS, CuS — черный цвет;
- CdS — желтый цвет;
- ZnS, MgS — белый цвет;
- MnS — розовый цвет.
Качественная реакция на сероводородную кислоту и ее соли (взаимодействие с растворимыми солями свинца с выделением сульфида свинца (II) в виде черного осадка):
Na2S + Pb(NO3)2 = PbS↓ + 2NaNO3 S2- + Pb2+ = PbS↓
В окислительно-восстановительных реакциях сероводород и его кислота выступают только в роли сильного восстановителя, что объясняется низшей возможной степенью окисления серы (-2).
S-2-2e- → S S-2-6e- → S+4 S-2-8e- → S+6
В окислительно-восстановительных реакциях сероводород легко окисляется с образованием S, SO2, H2SO4:
- кислородом воздуха:
2H2S-2+3O2 = 2S+4O2-2+2H2O-2 (горение сероводорода)
- бромной водой, которая обесцвечивается, теряя желто-оранжевый оттенок, при пропускании через нее сероводорода:
H2S-2+Br2 = 2HBr-1+S↓
- марганцовкой — сероводород обесцвечивает раствор перманганата калия:
5H2S-2+2KMn+7O4+3H2SO4 = K2SO4+2MnSO4+5S↓+8H2O
- более слабыми окислителями, например, солями железа и сернистой кислотой:
2Fe+3Cl3+H2S-2 = 2Fe+2Cl2+S↓+2HCl H2S+4O4+2H2S-2 = 3S↓+3H2O
Подробнее см. Уравнения окислительно-восстановительных реакций сероводорода…
Способы обеззараживания воды
 После очищения скважинной шахты нужно установить фильтрационные устройства, убирающие соединения сероводорода из воды. Есть вероятность, что источник загрязнения вне гидросооружения, и серобактерии могут вновь попасть в шахту.
После очищения скважинной шахты нужно установить фильтрационные устройства, убирающие соединения сероводорода из воды. Есть вероятность, что источник загрязнения вне гидросооружения, и серобактерии могут вновь попасть в шахту.
Наиболее эффективные методы:
- Физическая аэрация с применением напорных и безнапорных дегазаторов. Последние имеют большие габариты и не герметичны. При помощи кислорода они очищают жидкость, попадающую внутрь через вводные форсунки. Чтобы ускорить выведение остатков отравляющих веществ, рекомендовано вмонтировать в резервуар воздушный компрессор. Устройства, работающие под напором, небольшие. Они быстро насыщают небольшие порции воды кислородом, прогоняя поток посредством насосной установки.
- Химическое обеззараживание. Подразумевает абсолютную дегазацию водяной массы, где в роли окислителя используются активные составляющие – перекись водорода, хлор, озон, марганцовка. Эти вещества находятся в специальных картриджах, через которые пропускается жидкость. При окислении появляются водонерастворимые соединения – серы, сульфата, тиосульфата, остающиеся в фильтрационном элементе.
- Сорбционно-каталитическое очищение. Предполагает применение специальных абсорбентов. Они способствуют ускорению окисления в серных соединениях. Главный минус сорбционного обеззараживания – продолжительность выполнения процедуры. Лучшими сорбционными наполнителями считаются натуральные материалы, обладающие микроскопическими порами, – древесный либо активированный уголь. У них повышенные каталитические показатели, позволяющие быстро и без проблем для окружающей среды провести чистку воды от любых примесей. А оксидные элементы осядут в наполнителе, и их удалят вместе с заменой картриджа.
 Система обратного осмоса для очистки воды
Система обратного осмоса для очистки воды
Можно установить обратноосмотическую колонну с мембраной, пропускающей исключительно молекулы воды. Очистка будет идеальной. Минус в том, что вместе с вредными взвесями из жидкости исчезнут и полезные вещества. Перед питьем воду придется пропускать через специальный минерализатор.
Лучше всего собрать систему из нескольких фильтрационных узлов либо установить комплексное очистительное и обеззараживающее оборудование.
Популярными фильтрами, избавляющими от вони и от вредного вещества в воде полностью, являются установки для обезжелезивания и умягчения с эффектом поглощения сероводорода. Их представляют известные фирмы «Аквафор» и «Гейзер». Цена фильтрационных устройств первого бренда стартует от 53000 рублей, второго – от 35000 рублей.
Удалить вредный сероводород в скважине навсегда и предотвратить опасные последствия можно, если решать эту проблему в комплексе. Нужно убрать запах и почистить источник от сернистых бактерий, а также установить фильтрационное устройство во избежание повторных проблем.
Реактивность и опасности
H2S считается стабильным соединением, хотя он легко воспламеняется и чрезвычайно токсичен.
Смесь тяжелее воздуха и может перемещаться на значительное расстояние от источника возгорания и обратно. Может образовывать взрывоопасные смеси с воздухом в широком диапазоне.
Он также вступает в взрывную реакцию с пентафторидом брома, трифторидом хлора, трийодидом азота, трихлоридом азота, дифторидом кислорода и хлоридом фенилдиазония.
При нагревании до разложения он выделяет высокотоксичные пары оксидов серы. Несовместим со многими материалами, включая сильные окислители, металлы, сильную азотную кислоту, пентафторид брома, трифторид хлора, трийодид азота, трихлорид азота, дифторид кислорода и хлорид фенилдиазония.
Сероводород (H2S) несет ответственность за многие случаи профессионального токсического воздействия, особенно в нефтяной промышленности. Клинические эффекты Н2S зависит от его концентрации и продолжительности воздействия.
H2S немедленно приводит к смертельному исходу, когда концентрации превышают 500-1000 частей на миллион (ppm), но воздействие более низких концентраций, таких как 10-500 ppm, может вызывать различные респираторные симптомы, начиная от ринита до острой дыхательной недостаточности..
H2S также может поражать несколько органов, вызывая временные или постоянные нарушения в нервной, сердечно-сосудистой, почечной, печеночной и гематологической системах..
Представлен случай профессионального воздействия H2Это приводит к поражению нескольких органов, острой дыхательной недостаточности, организации пневмонии и шока, сходных с острым сепсисом. В этом случае у пациента также развилось легкое обструктивное и рестриктивное заболевание легких и периферическая невропатия (Al-Tawfiq, 2010).
ингаляция
В случае вдыхания выносите его на улицу и держите в покое в удобном для дыхания положении. Если не дышите, примените искусственное дыхание. Если дыхание затруднено, обученный персонал должен дать кислород.
Контакт с кожей
При попадании на кожу ее следует промыть большим количеством воды. Жидкость под давлением может вызвать обморожение. В случае воздействия жидкости под давлением зону замораживания следует немедленно нагреть теплой водой, не превышающей 41 ° C..
Температура воды должна быть терпимой к нормальной коже. Прогревание кожи следует поддерживать в течение не менее 15 минут или до тех пор, пока в пораженный участок не вернется нормальная окраска и ощущение. В случае массивного воздействия одежду снимают во время душа теплой водой.
Зрительный контакт
В случае попадания в глаза тщательно промыть глаза водой не менее 15 минут. Держите веки открытыми и подальше от глазных яблок, чтобы убедиться, что все поверхности тщательно промыты..
Проглатывание не считается возможным путем воздействия. Во всех остальных случаях требуется немедленная медицинская помощь (Praxair, 2016).
Сероводород в естественной среде
Микробный: цикл серы
Ил из пруда; черный цвет из-за сульфидов металлов
Сероводород является центральным участником цикла серы , биогеохимического цикла серы на Земле.
При отсутствии кислорода , серы , уменьшая и сульфатредуцирующие бактерий , получают энергию от окислительного водорода или органических молекул путем уменьшения элементарной серы или сульфата до сероводорода. Другие бактерии выделяют сероводород из серосодержащих аминокислот ; это вызывает запах тухлых яиц и способствует запаху метеоризма .
Поскольку органическое вещество разлагается в условиях с низким содержанием кислорода (или гипоксии ) (например, в болотах, эвтрофных озерах или мертвых зонах океанов), сульфатредуцирующие бактерии будут использовать сульфаты, присутствующие в воде, для окисления органического вещества, производя сероводород в виде трата. Часть сероводорода будет реагировать с ионами металлов в воде с образованием сульфидов металлов, которые не растворимы в воде. Эти сульфиды металлов, такие как сульфид железа FeS, часто имеют черный или коричневый цвет, что приводит к темному цвету шлама .
Некоторые группы бактерий могут использовать сероводород в качестве топлива, окисляя его до элементарной серы или сульфата, используя растворенный кислород, оксиды металлов (например, оксигидроксиды Fe и оксиды Mn) или нитраты в качестве акцепторов электронов.
В пурпурных серных бактериях и зеленые серные бактерии используют сероводород в качестве донора электронов в процессе фотосинтеза , в результате чего получают элементарную серу. Этот способ фотосинтеза старше, чем режим цианобактерий , водорослей и растений , который использует воду в качестве донора электронов и высвобождает кислород.
Биохимия сероводорода — ключевая часть химии мира железо-сера . В этой модели происхождения жизни на Земле геологически полученный сероводород постулируется как донор электронов, приводящий к восстановлению углекислого газа.
Животные
Сероводород смертелен для большинства животных, но некоторые узкоспециализированные виды ( экстремофилы ) действительно процветают в местах обитания, богатых этим соединением.
В глубоком море гидротермальные источники и холодные выходы с высоким уровнем сероводорода являются домом для ряда чрезвычайно специализированных форм жизни, от бактерий до рыб. Из-за отсутствия света на этих глубинах эти экосистемы полагаются на хемосинтез, а не на фотосинтез .
Пресноводные пружины богаты сероводородом, в основном , домом для беспозвоночных, но и включать в себя небольшое количество рыбы: Cyprinodon bobmilleri (а pupfish из Мексики), Limia sulphurophila (а poeciliid из Доминиканской Республики ), Gambusia eurystoma (а poeciliid из Мексики), и несколько Poecilia (поецилииды из Мексики). Беспозвоночные и микроорганизмы в некоторых пещерных системах, таких как пещера Мовиле , адаптированы к высоким уровням сероводорода.
Межзвездное и планетарное явление
Сероводород часто обнаруживается в межзвездной среде. Это также происходит в облаках планет в нашей солнечной системе.
Массовые вымирания
Цветок сероводорода (зеленый), растянувшийся на 150 км вдоль побережья Намибии. Когда бедная кислородом вода достигает побережья, бактерии в богатых органическими веществами отложениях производят сероводород, который токсичен для рыб.
Сероводород был причастен к нескольким массовым вымираниям , произошедшим в прошлом Земли. В частности, накопление сероводорода в атмосфере могло вызвать или, по крайней мере, способствовало пермско-триасовому вымиранию 252 миллиона лет назад.
Органические остатки на этих границах вымирания указывают на то, что океаны были бескислородными (обедненными кислородом) и имели виды мелкого планктона, которые метаболизировали H2S . Образование H2S, возможно, был вызван массивными извержениями вулканов, в результате которых в атмосферу были выброшены углекислый газ и метан , которые нагрели океаны, снизив их способность поглощать кислород, который в противном случае окислял бы H2S . Повышенный уровень сероводорода мог убить растения, производящие кислород, а также разрушить озоновый слой, вызвав дальнейший стресс. Маленький H2Цветение S было обнаружено в наше время в Мертвом море и в Атлантическом океане у побережья Намибии .
токсикология
токсичность
Сероводород — чрезвычайно ядовитый газ, который очень быстро может привести к смерти, что подтверждается многочисленными сообщениями о несчастных случаях в химической промышленности. Из-за своей немного большей плотности, чем у воздуха, газ собирается на земле.
Характерный запах тухлых яиц (сероводород также образуется в тухлых яйцах) воспринимается индивидуально при концентрации от 0,0005 до 0,13 частей на миллион и является преимуществом перед другими смертоносными газами. Однако к запаху привыкаешь, и при более высоких концентрациях запах не ощущается, поскольку сероводород обладает свойством притуплять обонятельные рецепторы . Зависимое от концентрации нейротоксическое повреждение обонятельного эпителия (слизистой оболочки носа) было обнаружено у крыс и мышей при концентрациях 30 ppm или более. Максимальная концентрация на рабочем месте (значение МАК, с 2006 года) составляет 5 частей на миллион.
Пороговое значение для анестезии обонятельных рецепторов человека составляет 200 ppm H 2 S.
Кратковременное ядовитое действие
При контакте со слизистыми оболочками и тканевой жидкостью глаз, носа, горла и легких сероводород образует сульфиды щелочных металлов, которые вызывают сильное раздражение. Одним из следствий этого является задержка воды в легких. Симптомы обычно проходят в течение нескольких недель.
Фактический токсический эффект основан на разрушении гемоглобина красного пигмента крови и, таким образом, параличе внутриклеточного дыхания. Механизм до сих пор неясен, предполагается, что обычно содержащие тяжелые металлы ферменты, переносящие кислород , инактивированы. Меньшая неокисленная часть сероводорода может вызвать повреждение центральной и, возможно, периферической нервной системы .
В следующие эффекты возникают на человека :
- от 20 ppm: повреждение роговицы после длительного воздействия
- ≈ 100 частей на миллион: раздражение слизистых оболочек этих глаз и дыхательных путей , слюноотделения , раздражение в горле
- > 200 ppm: головная боль , затрудненное дыхание
- > 250 ppm: оглушение обонятельных рецепторов
- > 300 частей на миллион: тошнота
- ≈ 500 промилле: слабость, сонливость, головокружение
- > 500 ppm: судороги , потеря сознания
Длительное воздействие низких доз может привести к усталости , потере аппетита , головной боли , раздражительности , плохой памяти и снижению концентрации внимания .
У человека возникают зависящие от концентрации симптомы отравления
- <100 ppm: через несколько часов
- > 100 частей на миллион: <1 час
- ≈ 500 частей на миллион: опасность для жизни через 30 минут
- ≈ 1000 ppm: опасно для жизни через несколько минут
- ≈ 5000 ppm (соответствует объемной доле 0,5%): смертельный исход через несколько секунд
Это означает, что даже концентрация H 2 S 0,1% приводит к летальному исходу через несколько минут. При таких концентрациях потеря сознания наступает при одном или нескольких вдохах.
Концентрация Н 2 S, который в человеческих клетках путем ингибирования клеточного дыхания является вредным, был в пробирке с 0,32 мкм моль / л определена.
Долгосрочный эффект
Исследования на животных показывают, что свиньи, которых кормили кормом, содержащим сероводород, через несколько дней страдали от диареи и примерно через 105 дней теряли вес.
Удаление — сероводород
Удаление сероводорода из артезианских вод посредством гидратов окислов железа с последующей их регенерацией.
Удаление сероводорода из продукции добывающих скважин позволяет уменьшить или предотвратить развитие сероводородной коррозии и образование отложений сульфида железа в нефтепромысловом оборудовании.
Удаление сероводорода из коксового газа ведется в настоящее время двумя основными методами: методами сухой и мокрой очистки. Удаление сероводорода осуществляется в абсорбере 1, орошаемом 20 % — ным раствором диэтаноламина. В подогревателе 2 температура газа повышается до 450 — 460 С за счет сжигания в межтрубном пространстве аппарата отопительного газа.
Удаление сероводорода из газа может производиться также при помощи растворов едких щелочей. При взаимодействии сероводорода и гидрата окиси натрия ( или калия) образуются соответствующие гидросульфиды.
Удаление сероводорода нужно провести немедленно после отделения центрифугата 2: если раствор будет стоять, S2 — окислится кислородом воздуха до SC 42 — и выпадает осадок нерастворимых сульфатов второй группы. Удалив сероводород, отделяют осадок от раствора центрифугированием или фильтрованием. После этого исследуют раствор согласно схеме, приведенной на стр.
Удаление сероводорода из газовой смеси значительно легче, чем сероорганических соединений.
Удаление сероводорода H2S из газа в блоке сероочистки осуществляется его промывкой селексолом: раствор селексола поглощает сероводород. Отработавший в газовой турбине газ поступает в котел-утилизатор ( на рис. 9.7 не показан), где вырабатывается слабоперегретый пар при давлении 1 3 МПа и температуре 250 С.
Удаление сероводорода производится в той же установке, что и осушка газа, только к раствору этиленгликоля добавляют дизталоламия или моноэтаноламин. Угольная кислота улавливается вместе с сероводородом. Таким образом, в одной и той же абсорбционной установке производится осушка газа, удаление сероводорода и угольной кислоты.
Удаление сероводорода может быть произведено физико-химическими или химическими методами.
Удаление сероводорода из воды после барометрических конденсаторов рекомендуется проводить в скрубберах или других дегазаторах воздухом; при этом воду предварительно подкисляют.
Удаление сероводорода из бензиновых дестиллатов достигается достаточно эффективно путем физической стабилизации. Стабилизированный дестиллат содержит лишь следы сероводорода, удаляемые химическими реагентами.
Удаление сероводорода из воды производят путем окисления его кислородом воздуха или хлором. При окислении сероводорода воздухом в качестве катализатора используют природный пиролюзит. При этом воду пропускают через дегазатор, загруженный зернистым пиролюзитом, навстречу потоку воздуха. Окисление сероводорода хлором сопровождается выделением коллоидной серы, которая может быть удалена из воды коагуляцией.
Применение сероводорода:
Из-за своей токсичности сероводород находит ограниченное применение:
– в аналитической химии сероводород и сероводородная вода используются как реагенты для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы;
– в медицине в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод;
– в химической промышленности для получения серной кислоты, элементной серы, сульфидов;
– в органическом синтезе для получения тиофена и меркаптанов.
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.
- https://ru.wikipedia.org/wiki/Сероводород
- https://en.wikipedia.org/wiki/Hydrogen_sulfide
- http://chemister.ru/Database/properties.php?dbid=1&id=818
Примечание: Фото https://www.pexels.com, https://pixabay.com.
Видео https://www.youtube.com/watch?v=RYZkPRGcc0k
Найти что-нибудь еще?
карта сайта
Коэффициент востребованности
6 871
Концентрация сероводорода в воздухе московского региона не превышает нормы
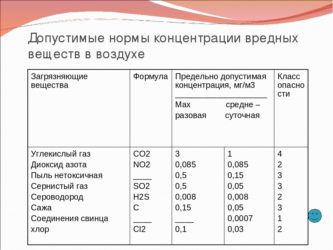
МОСКВА, 11 ноября. /ТАСС/. В Москве и Подмосковье не было выявлено превышений концентрации в воздухе опасных веществ, в том числе сероводорода. Ситуация спокойная, однако источник неприятного запаха пока не установлен. Об этом сообщил журналистам замглавы МЧС Владимир Степанов.
Накануне предельно допустимая концентрация (ПДК) сероводорода в воздухе в столичном регионе превысила норму в несколько раз, но даже такое превышение не является опасным для здоровья человека.
По данным МЧС, в понедельник 10 ноября после 14:00 мск стали поступать звонки от жителей востока и юго-востока Москвы с жалобами на неприятный запах, предположительно, сероводорода. Сразу после его появления МЧС и другие службы усилили мониторинг воздуха.
Концентрация сероводорода в норме
Как отметил замглавы МЧС, концентрация по сероводороду в московском регионе не превышала норму уже со второй половины дня 10 ноября. «Вечером 10 ноября к 18:00 мск жители перестали звонить с сообщениями о запахе», — сообщил Степанов.
Нормализацию ситуации с сероводородом подтвердил на заседании президиума столичного правительства начальник ГУ МЧС по Москве Александр Елисеев.
«Вчера превышение было в 7 раз, сегодня превышение достигло нормы ПДК. Мониторинг состояния воздуха ведут около 70 лабораторий», — отметил он.
По данным Мосэкомониторинга на 09:00 мск, вблизи автотрасс максимальные разовые концентрации загрязняющих веществ в атмосферном воздухе столицы составили: оксид углерода — до 0,3 ПДК, диоксид азота — до 0,4 ПДК, оксид азота — до 0,2 ПДК, взвешенные частицы — менее 0,1 ПДК, диоксид серы — менее 0,1 ПДК.
На других территориях аналогичные показатели достигали: оксид углерода — до 0,3 ПДК, диоксид азота — 0,1-0,4 ПДК, оксид азота — до 0,2 ПДК, взвешенные частицы РМ10 — 0,1-0,2 ПДК, приземный озон — менее 0,1 ПДК, сероводород — 0,1-0,5 ПДК, диоксид серы — менее 0,1 ПДК.
Как сообщил замглавы МЧС Владимир Степанов, 11 ноября я во второй половине дня «начнется движение воздушных масс». «Думаю, что никакого запаха вообще не останется», — сказал он.
Возможные источники запаха
Глава столичного управления МЧС РФ пояснил, что по розе ветров запах пришел в центр города из Юго-Восточного округа, предположительно, с нефтеперерабатывающего завода.
«Что касается химического состава загрязнения, то речь идет о сероводороде и диоксиде серы. Диоксид серы применяется в технологических процессах при переработке нефтепродуктов», — пояснил он.
Как сообщил замглавы МЧС Владимир Степанов, причины появления запаха сероводорода в Москве будут устанавливать правоохранительные органы и Росприроднадзор. «В причинах будут разбираться правоохранительные органы и по линии Росприроднадзора. На данный момент пока причина не установлена», — сказал он.
Создана группа специалистов, которая отрабатывает несколько предприятий, которые могли стать источником запаха сероводорода.
«Сказать однозначно, откуда появился запах, пока нельзя», — отметил Степанов.
Мэр требует эффективного расследования
Мэр Москвы Сергей Собянин в свою очередь поручил довести до конца расследование по выявлению источника запаха сероводорода.
«Вы до конца доведите расследование, чтобы у нас была четкая причина аварии, чтобы в последующем предотвратить такие случаи», — сказал градоначальник, обращаясь на заседании президиума правительства Москвы к начальнику ГУ МЧС России по Москве.
Елисеев заверил, что сейчас специалисты МЧС совместно со Следственным комитетом и прокуратурой работают как на нефтеперерабатывающем заводе, так и на других предприятиях.
Сероводород не опасен для человека, если он его чувствует
Как уверяет главный токсиколог Минздрава РФ Юрий Остапенко, кратковременное воздействие сероводорода на организм человека абсолютно безопасно для здоровья.
«Кратковременное воздействие на человека безопасно в принципе. К тому же наш нос воспринимает запах сероводорода только на уровне нетоксических концентраций.
Когда концентрация этого вещества становится опасной для здоровья, обонятельные рецепторы блокируются.
Так что, если мы чувствуем запах, то опасности нет», — сказал Остапенко.
Клинические проявления отравления сероводородом, по его словам, это — резь в глазах, кашель, чихание, а в тяжелых случаях — потеря сознания. «Но у нас такого не было.
Способы очистки воды от сероводорода

Пример напорной очистки воды, где жидкость подаётся в ёмкость через распылители
Если вы не знаете, что делать, чтобы привести свой колодец в порядок, то прислушайтесь к рекомендациям специалистов.
Чтобы удалить запах, появляющийся сразу после подачи воды в систему, нужно провести первоначальное отстаивание жидкости. В этом случае при контакте воды с кислородом сероводород просто улетучится. Однако отстаивать водичку просто дома в кастрюлях не рекомендуется. Для такого случая можно делать и использовать два вида резервуаров:
В первом случае используются большие пластиковые бочки ёмкостью 200-300 литров. В них вода подаётся через специальные распылители по типу душевой лейки, которые обеспечивают взаимодействие жидкости с кислородом. Причём резервуары должны быть открытого типа (то есть без верхней крышки). В результате газ окисляется и улетучивается. Уже из такого резервуара после очистки вода может подаваться в чистом виде в дом, если установлена хорошая насосная система.
Важно: использовать металлические бочки в этом случае нельзя, поскольку сероводород разрушает железо
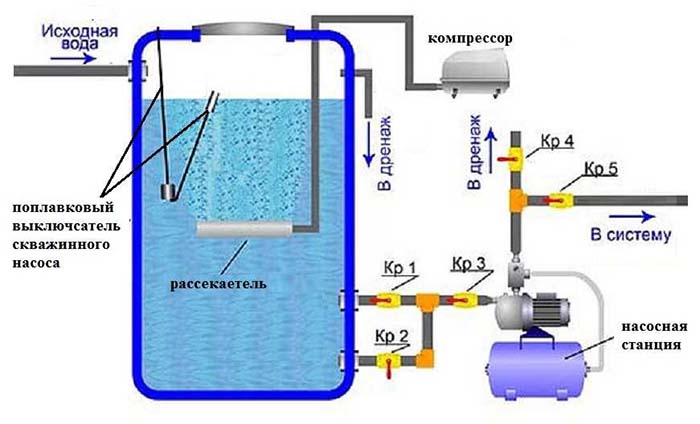
Пример аэрации воды при помощи компрессора
Напорные системы для очистки воды от сероводорода работают по другому принципу. Здесь вода из колодца проходит через фильтры и заполняет резервуар. Потом под напором жидкость поднимается к верхней части бочки и уже отправляется по системе в дом. Таким образом, происходит отстаивание воды, а газ улетучивается с её поверхности после поднятия к высшей точке. Делать тот или иной вид отстойника нужно в зависимости от ваших предпочтений и финансовых возможностей.
Очистка через окисление
Можно использовать и другую систему очистки воды от сероводорода. В этом случае используются химикаты в виде серы или гипохлорида натрия, добавляемые в воду. В результате происходит реакция сероводорода с химическими элементами и газ испаряется. Доочистить воду помогают здесь специальные фильтры с зернистым содержимым.
Важно: замена фильтра в такой системе очистки должна быть регулярной. Если пропустить этот момент, то вместе с водой вы рискуете получить вредные для здоровья химикаты
Использование сорбентов
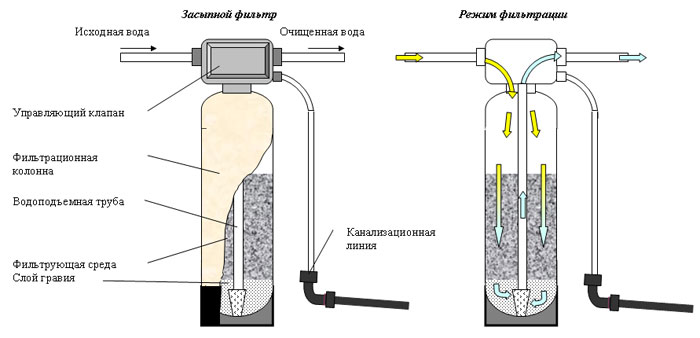
Пример работы и устройства угольного фильтра для очистки воды от сероводорода
Еще один способ, при помощи которого можно избавиться от запаха сероводорода — это применение угольного фильтра. В его состав входит гранулированный активированный уголь, который отлично окисляет вредные соединения в воде и собирает их на себя
Важно производить замену фильтра в соответствии с рекомендациями
Замена нагревательного оборудования
Если случается так, что пахнет неприятно вода именно после нагревания, то в этом случае нужно обратить особенное внимание на нагревательную систему. Бывает, что на стенках нагревательного прибора от времени скапливаются вредные серные или нитратные бактерии, которые осуществляют свою жизнедеятельность, а при нагревании ещё и активизируются
В этом случае рекомендуется либо почистить нагревательный элемент, либо полностью заменить его.
Важно: оттягивать с удалением запаха сероводорода из воды ни в коем случае не стоит. Здоровье домочадцев — прежде всего
физиология
метаболизм
Структурная формула из цистеина
Лента модель из цитохром с — оксидазы . Сероводород блокирует сайт связывания для кислорода в активном центре .
- С.уsтеяп+ЧАС2О⟶С.еряп+ЧАС2С.{\ displaystyle \ mathrm {Цистеин + H_ {2} O \ longrightarrow Serine + H_ {2} S}}
Другая реакция того же фермента, который происходит из цистина , но не играет роли у людей, была продемонстрирована на крысах :
- С.уС.-С.С.у⟶П.уртыvат+NЧАС3+С.уС.-С.ЧАС→2ЧАС+С.уs+ЧАС2С.{\ displaystyle \ mathrm {CyS {\ text {-}} SCy \ longrightarrow пируват + NH_ {3} + CyS {\ text {-}} SH {\ xrightarrow {2H ^ {+}}} Cys + H_ {2} S}}
Газ быстро соединяется с тиоловыми остатками близлежащих белков (-Cys становится -CySSH) и тем самым изменяет их биологическую активность. В частности , это дезактивирует фермент цитохром с оксидазу . Однако большинство из них окисляется до сульфата в митохондриях через тиосульфат и сульфит или превращается в сульфит / сульфат или таурин через сульфинат цистеина .
Окисление до сульфата
Митохондрии защитить себя от H 2 S или HS — через его окисление до сульфата, который проходит в три этапа:
- 2 ЧАСС.-+О2+ЧАС2О⟶С.2О32-+4-й е-+4-й ЧАС+{\ displaystyle \ mathrm {2 \ HS ^ {-} + O_ {2} + H_ {2} O \ longrightarrow S_ {2} O_ {3} ^ {2 -} + 4 \ e ^ {-} + 4 \ H ^ {+}}}
- С.2О32-+2 граммС.ЧАС⟶С.О32-+ЧАС2С.+граммС.С.грамм{\ displaystyle \ mathrm {S_ {2} O_ {3} ^ {2 -} + 2 \ GSH \ longrightarrow SO_ {3} ^ {2 -} + H_ {2} S + GSSG}}
- С.2О32-+Р.С.ЧАС⟶С.О32-+Р.С.С.ЧАС{\ displaystyle \ mathrm {S_ {2} O_ {3} ^ {2 -} + RSH \ longrightarrow SO_ {3} ^ {2 -} + RSSH}}
- С.О32-+ЧАС2О⟶С.О4-й2-+2 е-+2 ЧАС+{\ displaystyle \ mathrm {SO_ {3} ^ {2 -} + H_ {2} O \ longrightarrow SO_ {4} ^ {2 -} + 2 \ e ^ {-} + 2 \ H ^ {+}}}
Наконец, сульфитоксидаза окисляет сульфит до сульфата. Подтверждение пути деградации в результате идентификации митохондриальной Schwefeldioxygenase с ETHE1 — геном , который в редкой мутации в генетических заболеваниях с повышенными повреждениями , вызванными Н 2 S концентрация приводит.
заявление
Сероводород потенциально может использоваться как средство от эректильной дисфункции. Он естественным образом образуется в эректильной ткани полового члена и гладких мышцах артерии полового члена . Эксперименты показали, что и L- цистеин, и сероводород (соль), поступающие извне, вызывают зависящую от концентрации эрекцию в эректильной ткани полового члена ( кавернозные тела полового члена ).
В низких концентрациях сероводород замедляет обменные процессы и снижает температуру тела мышей. Это состояние, похожее на спячку, полностью обратимо и безвредно для животных. Продолжаются исследования относительно того, можно ли использовать этот эффект в трансплантологии для улучшения качества и времени выживания органов, предназначенных для трансплантации. Кроме того, в исследованиях на людях изучается, может ли сероводород повысить вероятность выживания пациентов, находящихся в экстренной помощи. Цель состоит в том, чтобы замедлить метаболизм путем вдыхания или инъекции H 2 S и, таким образом, уменьшить потребность в кислороде. В идеале эта мера должна быть уже доклинической, например Б. Службой скорой помощи .
В исследовании 2007 года, проведенном в Университете Алабамы в Бирмингеме , которое было опубликовано в журнале Proceedings of the National Academy of Sciences , считается, что очень низкие дозы сероводорода являются основным фактором воздействия чеснока на здоровье . Авторы сообщают, что чеснок снижает риск сердечных заболеваний из-за высокого кровяного давления, повышенного содержания жира в крови ( холестерина ) и других факторов. В группах населения, потребляющих много чеснока, меньше проблем с высоким кровяным давлением.
Классификация нефти по содержанию серы
Классификация нефтяных образцов осуществляются по множеству признаков. По содержанию серы в нефти все образцы подразделяют на 4 класса. Концентрация сернистых примесей определяется в массовых долях и у каждого класса нефти находится в определенном диапазоне.
По содержанию серы нефти делятся на:
-
Малосернистую нефть– до 0,6% включительно;
-
Сернистую нефть – 0,61-1,8%;
-
Высокосернистую нефть – 1,81-3,5%;
-
Особо высокосернистую нефть – более 3,51%.
Нефти первого класса содержат порядка 0,5% серы в составе различных загрязняющих веществ. Количество таких примесей в особо высокосернистых образцах редко превышает 10% по массе, однако может доходить до 14%.
Для уменьшения количества серосодержащих веществ сернистую нефть подвергают гидроочистке.
