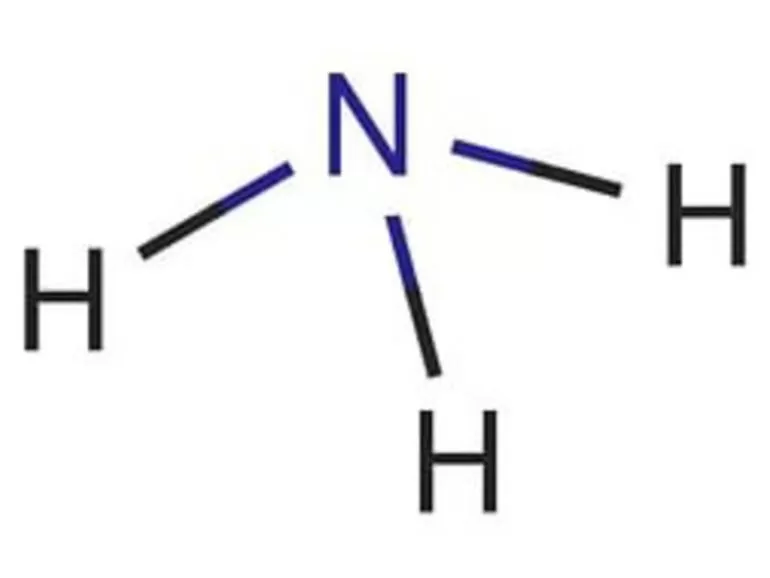
Аммиак ( нитрид водорода )
Содержание:
- Что делать после отравления?
- Симптоматика отравления химическим соединением
- [править] Физические свойства
- Фармакодинамика и фармакокинетика
- [править] Гидроксид аммония
- Физические свойства аммиака:
- Первая неотложная помощь при аммиачном отравлении
- Последствия и осложнения
- Как правильно утилизировать аммиак и его отходы на предприятиях
- Химические свойства
- Поведение в почве
- Оставить заявку
- Пригласить на тендер
- Приложения
- Разложение и взрывоопасность
- Клиническая информация, средства защиты, первоочередные действия в очаге
- 8.3. Химическая и принципиальная схемы производства
- Степени окисления азота в разных соединениях
- Аммиак
- Физические и химические свойства
Что делать после отравления?
После отравления человека госпитализируют, и он находится в токсикологическом отделении. 24 часа после отравления за самочувствием пациента наблюдают специалисты. Больному назначается постельный режим, даже если симптоматика уже отсутствует. Если симптомы все же наблюдаются, проводится симптоматическая терапия.
Если у пациента ярко выраженный ларингоспазм, проводят трахеостомию
Также проводится комплексное лечение ожогов на коже, большое внимание уделяется роговице. В профилактических целях выписываются антибиотики и иные лекарственные препараты, которые предотвращают развитие пневмонии и других болезней внутренних органов
Симптоматика отравления химическим соединением
Существует три главных пути проникновения газа в человеческий организм: первый – через глаза, второй – через кожный покров, третий – через дыхательные пути. Газообразное вещество имеет высокую разрушительную активность, поэтому первые признаки отравления появляются моментально. Даже если человек дышит токсичными парами краткий период времени, возникает риск отравления.
К первым симптомам аммиачного отравления относятся:
- слизистые выделения из носа;
- хрипота;
- гиперемия, т.е. покраснение – слизистые оболочки переполняются кровью;
- выступающие слезы на глазах;
- повышенное слюноотделение;
- першение и боли в горле;
- сильный сухой кашель;
- чувство асфиксии.
Также нередко возникают: головная боль; тошнота, переходящая в рвоту; боль в животе; чувство сдавливания в грудной клетке; изжога. Если раствор аммиака был очень концентрированным, у человека появляется серьезная симптоматика в виде поражения органа зрения (из-за ожога глаз возможна слепота), кожных покровов (из-за химического ожога образовываются болезненные бляшки или корочки), верхних дыхательных путей (может возникнуть отечность легких, нарушение дыхательной системы и циркуляции крови, возможна пневмония).
Аммиачное отравление грозит внутренним органам и системам. При ожогах внутренних органов пострадавший может умереть, оказанная первая помощь будет бесполезной. Прогнозировать степень поражения легких, глаз, носоглотки можно лишь зная о концентрации вещества и длительности вдыхания газа.
[править] Физические свойства
Аммиак — бесцветный газ с характерным резким запахом и едким вкусом. Он почти в два раза легче воздуха. При −33,35 °С и обычном давлении аммиак сжижается в бесцветную жидкость, а при −77,75 °C замерзает, превращаясь в бесцветную кристаллическую массу. Его хранят и транспортируют в жидком состоянии в стальных баллонах под давлением 6-7 атм.
В воде аммиак растворяется очень хорошо: при 0 °С и обычном давлении в 1 объеме воды растворяется около 1200 объемов NH3, а при 20 °С — 700 объемов. Концентрированный раствор содержит 25 % NH3 и имеет плотность 0,91 г/см3. Раствор аммиака в воде называют аммиачной водой или нашатырным спиртом. Обычный медицинский нашатырный спирт содержит до 10 % NH3, аммиачная вода — от 10 % и более. При нагревании раствора аммиак легко испаряется.
Фармакодинамика и фармакокинетика
- Почему опасен аммиак?
- Как влияет аммиак на здоровье человека
- Справочник химика 21
- Аммиак: чем опасен и как действовать при отравлении
- Аммиак и его воздействие на организм человека
- “Аммиак очень опасен тем, что распространяется по ветру”
Если отравление произошло с помощью высококонцентрированного раствора, то у пострадавшего возможен ожёг верхних дыхательных путей, который впоследствии приводит к отёку и пневмонии лёгких. При выведении тараканов тоже хорошо помогает моногидрат аммиака. Для этого следует немного средства добавить в ведро с водой при мытье пола, мебели и стен (на литр воды примерно 1 ч. л.). Резкий запах прогонит незваных гостей, особенно если процедуру делать раз в неделю. Чтобы отдых на природе не был испорчен укусами комаров и мошки, необходимо взять с собой раствор аммиака и разбрызгать его вокруг.
[править] Гидроксид аммония
При растворении аммиака в воде часть его молекул взаимодействует с водородными ионами воды с образованием сложного катиона аммония NH4+. Вместе с тем соответствующие гидроксильные группы OH− воды освобождается. Этот процесс равновесный. Его можно изобразить следующим уравнением:
NH_3 + H_2O \; \overrightarrow{\leftarrow} NH_4 ^ + + OH ^ — \; \overrightarrow{\leftarrow} NH_4OH
Отсюда следует, что в растворе аммиака в равновесии одновременно существуют молекулы аммиака, воды и гидроксида аммония.
Гидроксид аммония — очень неустойчивое вещество и может существовать только в растворе. При нагревании раствора равновесие смещается влево, и раствор разлагается на исходные вещества. Это разложение частично происходит и при обычной температуре, поэтому растворы аммиака всегда имеют специфический запах. При длительном кипячении раствора можно полностью удалить аммиак. Этим иногда пользуются в лабораториях для получения небольших количеств аммиака.
Раствор гидроксида аммония окрашивает лакмус в синий цвет. С кислотами раствор гидроксида аммония образует соли, например:
- NH4OH + HCl = NH4Cl + H2O
- NH4OH + HNO3 = NH4NO3 + H2O
- 2NH4OH + H2SO4 = (NH4)2SO4 + 2H2O
Физические свойства аммиака:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | с резким характерным запахом (запах «нашатырного спирта») |
| Вкус | едкий |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность жидкости (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 682,8 |
| Плотность газа (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 0,8886 |
| Плотность (при 15 °C и атмосферном давлении 1 атм.), кг/м3 | 0,73 |
| Плотность (при 25 °C и атмосферном давлении 100 кПа ≈ 1 атм.), кг/м3 | 0,7723 |
| Температура плавления, °C | -77,73 |
| Температура кипения, °C | -33,34 |
| Критическая температура*, °C | 132,4 |
| Критическое давление, МПа | 11,32 |
| Критический удельный объем, м3/кг | 0,00426 |
| Коэффициент теплопроводности газа (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,026 |
| Температура самовоспламенения, °C | 651 ± 1 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 14,5 (15,0) до 33,6 |
| Взрывоопасные концентрации смеси газа с кислородом, % объёмных | от 13,5 до 82 |
| Удельная теплота сгорания, МДж/кг | 20,5 |
| Температура пламени, °C | 700 |
| Константа диссоциации кислоты | 9,21 ± 0,01 |
| Молярная масса, г/моль | 17,0304 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Первая неотложная помощь при аммиачном отравлении

При возможности следует сделать промывание ротовой и носовой полости водой с добавлением лимонной кислоты. Для снятия первых симптомов рекомендуется закапать в глаза лекарственный раствор «Дикаин» и надеть очки для защиты от солнечных лучей. Если наблюдается поражение верхнего отдела пищеварительного тракта, необходимо провести промывание желудка с помощью слабого солевого раствора.
При повреждении слизистых оболочек и эпидермиса, нужно промыть травмированные места теплой проточной водой и наложить стерильную повязку или обмотать их эластичным бинтом.
Если в помещении ощущается неприятный токсичный запах, следует первым делом защитить верхние дыхательные пути. Для этого к носу и губам необходимо приложить повязку из марли, ранее смоченную в растворе столового уксуса или лимонной кислоты. С целью облегчения состояния пострадавшего, ему следует вдыхать пары через специальный прибор для ингаляций.
Если у пострадавшего остановилось дыхание и он потерял сознание, нужно провести ему искусственную вентиляцию легких с помощью методик «рот в рот» или «рот в нос». Эту манипуляцию желательно делать без перерывов, дожидаясь приезда медицинских работников, которые приступят к оказанию квалифицированной медпомощи.
Последствия и осложнения
Тяжелые отравления нитридом водорода чреваты развитием таких осложнений, как отек легких, острая сердечная недостаточность, острая токсическая энцефалопатия, острая недостаточность функции печени, почек. Эти состояния нуждаются в специальном стационарном лечении в отделении интенсивной терапии или реанимации.
Отдаленные последствия отравления аммиаком также развиваются после тяжелой интоксикации. Они часто проявляются расстройством функции мозга: снижением памяти, мыслительных способностей, формированием судорожного синдрома, возможны и психические расстройства (депрессия, галлюцинаторный синдром).
Высока вероятность развития сосудистой дистонии из-за снижения тонуса стенок артерий. Характерна гипотония с приступами головокружения, головные боли. Со стороны дыхательных путей может сформироваться хронический обструктивный бронхит, пневмония и даже астма.
Ожоги глаз парами аммиака могут привести к развитию воспаления и помутнения оболочек глаза, снижению зрения.
Это интересно: Транспортные средства
Как правильно утилизировать аммиак и его отходы на предприятиях
Организуется процесс вывоза отработанных компонентов. Для этого следует изучить, какие услуги предоставляют компании данной сферы. Выбрав подходящую организацию, оформляют документацию для дальнейших работ.
Интенсивность запаха аммиака высокая (в 1,5 раза выше нормы). Кроме того, газ отличается летучестью, он токсичен. Значит, хранить его нужно в отдельном помещении. Причем доступ к веществу ограничивается: к операциям с аммиаком допускаются ответственные лица.
 Временное хранение аммиака
Временное хранение аммиака
Подготовить пакет документов для передачи отхода специализированной компании
Нитрид водорода относится к отходам, которые должны проходить процедуру утилизации. Чаще всего для этого приходится обращаться к услугам компаний, занимающихся вывозом, переработкой мусора. Передать нитрид водорода можно при наличии паспорта. Этот документ подтверждает принадлежность к 4 классу опасности, оформляется на основании результатов анализа, выполненного аккредитованной лабораторией.
 Для передачи аммиачных отходов необходим паспорт отходов
Для передачи аммиачных отходов необходим паспорт отходов
Оформить договор с компанией, которая сможет утилизировать эти отходы
Чтобы организация регулярно вывозила отходы, заключается договор. Он содержит информацию: тип веществ, которые будут транспортироваться, график вывоза, обязанности и права сторон.
 К договору прикладывается копия лицензии
К договору прикладывается копия лицензии
Химические свойства
По свойствам аммиак замечательный растворитель для разнообразных органических и неорганических составов. В твёрдом состоянии представляет собой кристаллы, не имеющие цвета. Может взаимодействовать с кислородом, хлоридом, серной кислотой, а также реагировать на водные и соляные растворы.
Аммиак обладает следующими химическими свойствами:
- Играет роль нуклеофила или комплексообразователя в химических реакциях. При присоединении протона образовывает аммоний: NH3 + H+ → NH4+.
- В жидком растворе происходит слабая щелочная реакция из-за протекающего процесса: NH 3 + H2О → NH4+ +ОН-.
- При воздействии кислот получается соль аммония, что демонстрирует уравнение: NH3 + HNO3 → NH4NO3.
- В соединении с металлами за счет кислотных свойств образует амиды: 2NH3 +2К →2КNH2 +Н2.
Состав амида, имида и нитрида металла образуют за счет реакции с аммиаком в жидком состоянии. Нитрид получают посредством прогревания металла в азотной атмосфере.
Амиды имеют идентичные свойства гидроксидам (за счет неэлектронных ионов ОН, NH2 и молекулы воды). Основание амида сильнее гидроксида, поэтому он подвержен гидролизу, который необратим.
Фенолфталеин в составе раствора приобретает красный оттенок, но после добавления кислот наступает процесс нейтрализации.
Аммиаку в жидком состоянии свойственны ионизирующие функции растворителя, который способен растворить щелочные металлы и щелочноземельные. При этом он приобретает синий цвет. Концентрированный раствор отличается блеском металла. Во время испарения металлы из щелочи получают в целом виде, а щёлочноземельные образуют с аммиаком комплексы со свойствами проводимости металлов.

В результате происходит распадение металлических атомов на ионы, которые положительно заряжены и электроны, сульфатированные в окружении молекул NH 3. Растворы с наличием свободных электронов имеют свойства сильнейших восстановителей.
За счет электронодонорного свойства частицы аммиака могут присутствовать в комплексных соединениях в виде лигандов. Для образования аминокомплексов вводят избыточное количество аммиака в солевой раствор металла.
Поведение в почве
При внесении аммиачной воды в почву аммиак адсорбируется почвенными коллоидами, поэтому его передвижение незначительно. Впоследствии аммиачный азот нитрифицируется, приобретает большую степень подвижности и мигрирует с почвенным раствором.
Внесение аммиачной воды повышает количество почвенных микроорганизмов, поскольку аммиак увеличивает количество растительных остатков, которыми питаются микроорганизмы. При этом непосредственно после внесения удобрения в почву в зоне его распространения наблюдается уменьшение количества почвенных микроорганизмов. После превращения аммиака в нитраты (это происходит весной за шесть недель) микроорганизмы сразу же размножаются в удобренной почве. Аммиачная вода убивает и дождевых червей. Однако их количество тоже быстро восстанавливается и даже увеличивается после превращения аммиака в нитраты или поглощения его растениями.
Оставить заявку
В случае, если Вы хотите, чтобы мы выполнили работу:
Выберите из списка инересующий вас вид работАудит промышленной безопасностиИдентификация и классификация ОПО, получение лицензии на эксплуатацию ОПОРазработка ПЛА, планов мероприятий, документации, связанной с готовностью предприятий к ГОЧС и пожарной безопасностиОбследование и экспертиза промышленной безопасности зданий и сооруженийРаботы на подъемных сооруженияхРаботы на объектах котлонадзора и энергетического оборудованияРаботы на объектах газового надзораРаботы на объектах химии и нефтехимииРаботы на объектах, связанных с транспортированием опасных веществРаботы на производствах по хранению и переработке растительного сырьяРаботы на металлургических литейных производствахРаботы на горнорудных производствахОценка соответствия лифтов, техническое освидетельствование лифтовРазработка обоснования безопасности опасного производственного объектаРазработка документации системы управления промышленной безопасностьюРазработка деклараций промышленной безопасностиРаботы на объектах Минобороны (ОПО воинских частей) и объектах ФСИН России (ОПО исправительных учреждений)ПроектированиеРемонтно-монтажные работыЭлектроремонтные и электроизмерительные работыРазработка и производство приборов безопасности для промышленных объектовРазработка и изготовление нестандартных металлоизделий и оборудованияНегосударственная экспертиза проектной документации (инженерных изысканий)Предаттестационная подготовка по правилам и нормам безопасностиПрофессиональное обучение (рабочие профессии)Обучение по охране труда, пожарной безопасности и электробезопасности, теплоэнергетикеСпециальная оценка условий труда (СОУТ) (до 2014г. аттестация рабочих мест)Аккредитация и аттестация в системе экспертизы промышленной безопасностиСертификация оборудования, декларирование соответствияЭнергоаудитРазработка схем теплоснабжения и водоснабженияДругие работыПовышение квалификации, профессиональная переподготовкаОсвидетельствование стеллажейперсональных данных
Пригласить на тендер
Если у Вас идет тендер и нужны еще участники:
Выберите из списка инересующий вас вид работАудит промышленной безопасностиИдентификация и классификация ОПО, получение лицензии на эксплуатацию ОПОРазработка ПЛА, планов мероприятий, документации, связанной с готовностью предприятий к ГОЧС и пожарной безопасностиОбследование и экспертиза промышленной безопасности зданий и сооруженийРаботы на подъемных сооруженияхРаботы на объектах котлонадзора и энергетического оборудованияРаботы на объектах газового надзораРаботы на объектах химии и нефтехимииРаботы на объектах, связанных с транспортированием опасных веществРаботы на производствах по хранению и переработке растительного сырьяРаботы на металлургических литейных производствахРаботы на горнорудных производствахОценка соответствия лифтов, техническое освидетельствование лифтовРазработка обоснования безопасности опасного производственного объектаРазработка документации системы управления промышленной безопасностьюРазработка деклараций промышленной безопасностиРаботы на объектах Минобороны (ОПО воинских частей) и объектах ФСИН России (ОПО исправительных учреждений)ПроектированиеРемонтно-монтажные работыЭлектроремонтные и электроизмерительные работыРазработка и производство приборов безопасности для промышленных объектовРазработка и изготовление нестандартных металлоизделий и оборудованияНегосударственная экспертиза проектной документации (инженерных изысканий)Предаттестационная подготовка по правилам и нормам безопасностиПрофессиональное обучение (рабочие профессии)Обучение по охране труда, пожарной безопасности и электробезопасности, теплоэнергетикеСпециальная оценка условий труда (СОУТ) (до 2014г. аттестация рабочих мест)Аккредитация и аттестация в системе экспертизы промышленной безопасностиСертификация оборудования, декларирование соответствияЭнергоаудитРазработка схем теплоснабжения и водоснабженияДругие работыПовышение квалификации, профессиональная переподготовкаОсвидетельствование стеллажейСкопируйте в это поле ссылку на Ваш тендер, для этого перейдите в браузер, откройте Вашу площадку, выделите и скопируйте строку адреса, затем вставьте в это поле. Если не получится напишите просто номер тендера и название площадки.персональных данных
Приложения
В отличие от безводного аммиака, водный раствор аммиака не находит применения вне ниши, кроме чистящих средств .
Бытовая уборка
Разбавленный (1–3%) аммиак также входит в состав многих чистящих средств, включая многие формулы для мытья окон. Поскольку водный раствор аммиака — это газ, растворенный в воде, когда вода испаряется из окна, газ также испаряется, оставляя окно без полос.
Помимо использования в качестве ингредиента в очищающих средствах с другими очищающими ингредиентами, аммиак в воде также продается как чистящее средство, обычно обозначаемое просто как «аммиак». Он может быть простым, с ароматом лимона (обычно желтого цвета) или с ароматом сосны (зеленый). Обычно доступный аммиак с добавлением мыла известен как «мутный аммиак».
Предшественник алкиламина
В промышленности водный аммиак можно использовать в качестве предшественника некоторых алкиламинов , хотя обычно предпочтительным является безводный аммиак. Гексаметилентетрамин легко образуется из водного раствора аммиака и формальдегида . Этилендиамин образуется из 1,2-дихлорэтана и водного аммиака.
Абсорбционное охлаждение
В первые годы двадцатого века с использованием водно-аммиачных систем был популярен и широко использовался, но после разработки цикла сжатия пара он потерял большую часть своего значения из-за низкого коэффициента полезного действия (примерно одна пятая часть). цикла сжатия пара). И холодильник Electrolux, и холодильник Эйнштейна являются хорошо известными примерами такого применения раствора аммиака.
Очистка воды
Аммиак используется для производства монохлорамина , который используется в качестве дезинфицирующего средства. Хлорамин предпочтительнее хлорирования из- за его способности дольше оставаться активным в стоячих водопроводных трубах, что снижает риск инфекций, передающихся через воду.
Аммиак используется аквариумистами для создания нового аквариума с использованием аммиачного процесса, называемого циклическим циклом без рыб . Это приложение требует, чтобы аммиак не содержал добавок.
Производство продуктов питания
Аммиак для выпечки ( бикарбонат аммония ) был одним из первых химических разрыхлителей . Его получали из рогов оленя. Он полезен в качестве разрыхлителя, потому что карбонат аммония активируется при нагревании. Эта характеристика позволяет пекарям избежать как длительного времени расстойки дрожжей, так и быстрого рассеивания CO 2 пищевой соды при выпекании хлеба и печенья. Его по-прежнему используют для приготовления аммиачного печенья и другой хрустящей выпечки, но его популярность снизилась из-за неприятного запаха аммиака и опасений по поводу его использования в качестве пищевого ингредиента по сравнению с современными формулами разрыхлителя. Ему присвоен номер E E527 для использования в качестве пищевой добавки в Европейском Союзе .
Водный аммиак используется в качестве регулятора кислотности для снижения уровня кислоты в пище. Он классифицируется в США Управлением по контролю за продуктами и лекарствами как общепризнанный безопасный (GRAS) при использовании версии для пищевых продуктов. Его способность контролировать pH делает его эффективным противомикробным средством.
Затемнение мебели
В мебельном производстве дымообразование аммиаком традиционно использовалось для затемнения или окрашивания древесины, содержащей дубильную кислоту . После герметизации в контейнере с древесиной пары аммиачного раствора вступают в реакцию с дубильной кислотой и солями железа, которые естественным образом содержатся в древесине, создавая богатый темный вид древесины. Эта техника обычно использовалась во время движения декоративно-прикладного искусства в мебели — стиль мебели, который в основном был построен из дуба и окрашен с использованием этих методов.
Обработка соломы для крупного рогатого скота
Раствор аммиака используется для обработки соломы и получения «аммиачной соломы», которая делает ее более съедобной для крупного рогатого скота .
Разложение и взрывоопасность
Детонация 15 г трииодида азота
Нестабильность NI 3 и NI 3 · NH 3 может быть объяснена большой стерической деформацией, вызванной тремя большими атомами йода, находящимися рядом друг с другом вокруг относительно крошечного атома азота. Это приводит к очень низкой энергии активации его разложения, реакция становится еще более благоприятной из-за высокой стабильности N 2 . Трииодид азота не имеет практической коммерческой ценности из-за его чрезвычайной чувствительности к ударам, что делает невозможным хранение, транспортировку и использование для контролируемых взрывов
Принимая во внимание, что чистый нитроглицерин также очень чувствителен к удару (хотя и не так сильно, как трииодид азота, который может быть выделен прикосновением пера) и мощный, только флегматизаторы уменьшили его чувствительность к удару, и он стал безопаснее обращаться и транспортировать в виде динамита .
Разложение NI 3 происходит следующим образом с образованием газообразного азота и йода:
- 2 NI 3 (т) → N 2 (г) + 3 I 2 (г) (-290 кДж / моль)
Однако сухой материал является контактным взрывчатым веществом, разлагающимся примерно следующим образом:
- 8 NI 3 · NH 3 → 5 N 2 + 6 NH 4 I + 9 I 2
В соответствии с этим уравнением эти взрывы оставляют пятна йода от оранжевого до пурпурного цвета, которые можно удалить с помощью раствора тиосульфата натрия. Альтернативный метод удаления пятен — просто дать йоду время для сублимации. Небольшие количества трийодида азота иногда синтезируют в качестве демонстрации для школьников-химиков или в качестве акта «химической магии». Чтобы подчеркнуть чувствительность соединения, его обычно взрывают при прикосновении к нему пером, но даже малейший поток воздуха, лазерный луч или другое движение могут вызвать детонацию . Трииодид азота также известен как единственное известное химическое взрывчатое вещество, которое детонирует при воздействии альфа-частиц и продуктов ядерного деления . Хотя это никогда не было показано на видео, изображениях и т. Д. Все, что нам нужно, это сказать об авторе упомянутых материалов, так как несколько попыток воспроизвести это действие не смогли воссоздать это утверждение. Это ставит под сомнение обоснованность утверждения о том, что NI 3 может быть взорван только с помощью альфа-излучения. Необходимо дальнейшее изучение и подтверждение этого явления.
Клиническая информация, средства защиты, первоочередные действия в очаге
| Общий характер действия |
|
| Средства защиты | Для химразведки и руководителя работ — ПДУ-3 (в течение 20 мин). Для аварийных бригад — изолирующие противогаз ИП-4М и спецодежда. При возгорании — огнезащитный костюм в комплекте с самоспасателем СПИ-20. Респираторы: РПГ-67-КД, РУ-60М-КД. Противогазы большого габарита: КД с/ф, КД8, КД б/ф. Изолирующие средства защиты: ПДУ-3, СПИ-20, ИП-4С, КИХ. Изолирующий костюм типа Л-1, Л-2. Костюм из полипропиленовой ткани. Защитные очки. Резиновые перчатки. |
| Химический очаг | |
| Вид очага | Нестойкий, быстродействующий. Пары легче воздуха. Пары при выходе в атмосферу дымят. |
| Первоочередные мероприятия |
Проведение поисково-спасательных работ в очаге, в том числе оказание первой медицинской помощи пострадавшим и их вынос (вывоз) на временные пункты сбора в оптимальные для спасения жизни и сохранения здоровья сроки, ведение разведки, обозначение и оцепление очага. Держаться с наветренной стороны. Избегать низких мест. Соблюдать меры пожарной безопасности. Устранить источники огня и искр. В опасную зону входить в защитных средствах. Не прикасаться к пролитому веществу. При интенсивной утечке дать газу полностью выйти. Изолировать район, пока газ не рассеется. Не приближаться к емкостям. Не прекращать горения при наличии утечки. Тушить горение порошками, газовыми составами. Охлаждать емкости водой с максимального расстояния. Пары осаждать тонкораспыленной водой. |
8.3. Химическая и принципиальная схемы производства
Основная стадия процесса синтеза аммиака из азотоводородной смеси описывается уравнением
Так как преобладающим методом получения АВС является конверсия метана воздухом и водяным паром, химическая схема производства аммиака включает помимо этой реакции несколько реакций воздушной и паровой конверсии:
и последующего превращения оксида углерода (II) в оксид углерода (IV):
После удаления оксида углерода (IV) из газовой смеси и коррекции ее состава получают АВС с содержанием азота и водорода в отношении 1 : 3.
Таким образом, современное производство аммиака состоит из двух стадий: приготовления АВС и превращения ее в аммиак, представляя единую энерготехнологическую схему, в которой сочетаются операции получения АВС, ее очистки и синтеза аммиака и эффективно используются тепловые эффекты всех стадий процесса, что позволяет в несколько раз снизить затраты электроэнергии. На рис. 8.5 приведена принципиальная схема производства аммиака, отвечающая рассмотренной выше химической схеме.
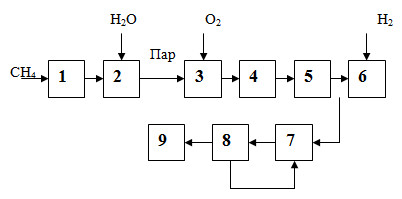
Рисунок 8.5 – Принципиальная схема производства аммиака:
- очистка природного газа от сернистых соединений;
- паровая конверсия метана;
- воздушная конверсия метана;
- конверсия оксида углерода (II);
- хемосорбционная очистка АВС;
- метанирование;
- синтез аммиака;
- абсорбция аммиака;
- сжатие аммиака.
Степени окисления азота в разных соединениях
Максимальное количество отрицательных частиц, которое способен присоединить его атом, равняется 3. В таком случае проявляется степень его окисления равная -3, присущая соединениям типа NH 3 или аммиаку, NH 4 + или аммонию и нитридам Me 3 N 2 . Последние вещества формируются при повышении температуры путем взаимодействия азота с атомами металлов.
Наибольшее количество отрицательно заряженных частиц, которое способен отдать элемент, приравнивается к 5.
Два атома азота способны соединяться между собой с образованием устойчивых соединений со степенью окисления -2. Такая связь наблюдается в N 2 H 4 или гидразинах, в азидах различных металлов или MeN 3 . Атом азота присоединяет на свободные орбитали 2 электрона.
Существует степень окисления -1, когда данный элемент получает только 1 отрицательную частицу. Например, в NH 2 OH или гидроксиламине он заряжен отрицательно.
Бывают положительного знака степени окисления азота, когда с внешнего энергетического слоя забираются электронные частицы. Варьируют они от +1 до +5.

Заряд 1+ имеется у азота в N 2 O (одновалентном оксиде) и в гипонитрите натрия с формулой Na 2 N 2 O 2 .
В NO (двухвалентном оксиде) элемент отдает два электрона и заряжается положительно (+2).
Существует степень окисления азота 3 (в соединении NaNO 2 или нитриде и еще в трехвалентном оксиде). В таком случае отщепляется 3 электрона.
Заряд +4 бывает в оксиде с валентностью IV или его димере (N 2 O 4).
Положительный знак степени окисления (+5) проявляется в N 2 O 5 или в пятивалентном оксиде, в азотной кислоте и ее производных солях.
Аммиак
Аммиак — одно из самых производимых неорганических химикатов. Существуют многочисленные крупные производства аммиака заводы по всему миру, производя в общей сложности 144 миллионов тонн азота ( что эквивалентно 175 млн т аммиака) в 2016 году Китай произвел 31,9% мирового производства, а затем России с 8,7%, Индия с 7,5%, а США — 7,1%. 80% или более производимого аммиака используется для удобрения сельскохозяйственных культур. Аммиак также используется для производства пластмасс, волокон, взрывчатых веществ, азотной кислоты (посредством процесса Оствальда ) и промежуточных продуктов для красителей и фармацевтических препаратов.
Физические и химические свойства
Аммиачная вода
Физические характеристики
- Плотность 18,5–25%-ного раствора – 0,930–0,910 г/см3 при +15°C.
- Парциональное давление паров аммиака – 0,1 МПа (при +40°C).
- Температура выпадения твердой фазы – от –31,3 до –53,9°C.
Аммиачная вода содержит до 30 % аммиака, то есть 24,6 % азота и 70 % воды. При температуре ниже +21,10°C не повышает давление, а при увеличении температуры лишь слегка повышает его. Один литр аммиачной воды весит 888 г и содержит 220 г азота.
Соединение вызывает коррозию цветных металлов (цинка, олова и меди) и их сплавов (латуни, бронзы). Черные металлы и чугун устойчивы к воздействию водного аммиака. Резина и алюминий аммиачной водой не повреждаются.
