Синильная кислота
Содержание:
- Производство и синтез
- Меры предупреждения
- Физические свойства
- Как яд и химическое оружие
- Получение[править | править код]
- Использование водорода в металлургии
- Преимущества применения водорода
- Токсичность и биологические свойства
- Примечания
- Применение
- Лечение
- История
- Получение
- Особенности обращения
- Биологическая роль
- Физические свойства
- Физиологические свойства[править | править код]
- Вхождение
Производство и синтез
Цианистый водород образуется, по крайней мере, в ограниченных количествах из многих комбинаций водорода, углерода и аммиака . Цианистый водород в настоящее время производится в больших количествах с помощью нескольких процессов, а также является вторичным отходом производства акрилонитрила . В 2006 году в США было произведено от 500 миллионов до 1 миллиарда фунтов (от 230 000 до 450 000 тонн).
Наиболее важным процессом является окисление Андруссова, изобретенное Леонидом Андруссовым из IG Farben, при котором метан и аммиак реагируют в присутствии кислорода при температуре около 1200 ° C (2190 ° F) над платиновым катализатором:
- 2 CH 4 + 2 NH 3 + 3 O 2 → 2 HCN + 6 H 2 O
Энергия, необходимая для реакции, обеспечивается частичным окислением метана и аммиака.
Менее важен процесс Degussa (процесс BMA ), в котором кислород не добавляется, а энергия должна передаваться косвенно через стенку реактора:
- СН 4 + NH 3 → HCN + 3H 2
Эта реакция сродни паровой конверсии , реакции метана и воды с образованием окиси углерода и водорода .
В процессе Шавинигана углеводороды , например пропан , реагируют с аммиаком. В лаборатории небольшие количества HCN получают путем добавления кислот к цианидным солям щелочных металлов :
- Н + + NaCN → HCN + Na +
Эта реакция иногда является причиной случайных отравлений, поскольку кислота превращает нелетучую цианидную соль в газообразный HCN.
Исторические методы производства
Большой спрос на цианиды для горных работ в 1890-х годах был удовлетворен Джорджем Томасом Бейлби , который запатентовал метод получения цианида водорода путем пропускания аммиака над раскаленным углем в 1892 году. Этот метод использовался до тех пор, пока Гамильтон Кастнер в 1894 году не разработал синтез из угля. , аммиак и натрий с образованием цианида натрия , который реагирует с кислотой с образованием газообразного HCN.
Меры предупреждения
Необходимо обеспечение строгой герметичности устройств и оборудования, из к-рого может выделиться HCN, и соблюдение мер по безопасности хранения С. к. и ее солей, их транспортировки, по уничтожению и обезвреживанию тары в соответствии с. сан. правилами проектирования, оборудования и содержания складов для хранения сильнодействующих ядовитых веществ, утвержденными М3 СССР.
На производствах, в воздух рабочих помещений к-рых может выделиться HCN, обязательно применение промышленных фильтрующих противогазов (см.) при высоких концентрациях HCN в воздухе — изолирующих противогазов. Кожа должна быть защищена резиновыми или полихлорвиниловыми перчатками, фартуками и сапогами
Важное значение имеет усовершенствование соответствующих технол. процессов с заменой цианистых соединений и С
к. на безопасные для человека хим. вещества, а также непрерывный контроль воздуха, рабочей зоны с автоматической звуковой и световой сигнализацией.
Все работающие должны знать о токсическом действии HCN и цианидов и о мерах первой помощи пострадавшим. На производствах, связанных с получением и применением С. к., где имеется опасность появления HCN в воздухе, 1 раз в год проводят медицинские осмотры (см. Медицинский осмотр). Работающим с С. к. и другими цианистыми соединениями предоставляют льготы.
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), мас. % | Конц. (г/л),кг HCl/м³ | Плотность,кг/л | Молярность,M | Водородный показатель (pH) | Вязкость,мПа·с | Удельнаятеплоемкость,кДж/(кг·К) | Давлениепара,Па | Т. кип.,°C | Т. пл.,°C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
При 20 °C, 1 атм (101 кПа)
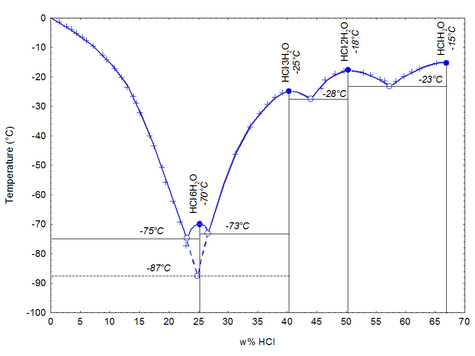
При низкой температуре хлороводород с водой даёт кристаллогидраты составов HCl⋅H2O{\displaystyle {\ce {HCl.H2O}}} (т. пл. −15,4 °С), HCl⋅2H2O{\displaystyle {\ce {HCl.2H2O}}} (т. пл. −18 °С), HCl⋅3H2O{\displaystyle {\ce {HCl.3H2O}}} (т. пл. –25 °С), HCl⋅6H2O{\displaystyle {\ce {HCl.6H2O}}} (т. пл. −70 °С). При атмосферном давлении (101,3 кПа) хлороводород с водой образуют азеотропную смесь с т. кип. 108,6 °С и содержанием HCl{\displaystyle {\ce {HCl}}} 20,4 мас. %.
Как яд и химическое оружие
Во время Первой мировой войны цианистый водород использовался французами с 1916 года в качестве химического оружия против центральных держав , а также Соединенными Штатами и Италией в 1918 году. Он не был признан достаточно эффективным из-за погодных условий. Газ легче воздуха и быстро рассеивается в атмосфере. Быстрое разбавление сделало его использование в полевых условиях непрактичным. Напротив, более плотные агенты, такие как фосген или хлор, как правило, оставались на уровне земли и уходили в траншеи на полях сражений Западного фронта. По сравнению с такими агентами цианистый водород должен присутствовать в более высоких концентрациях, чтобы стать фатальным.
Концентрация цианистого водорода 100–200 частей на миллион в воздухе для дыхания убьет человека в течение 10–60 минут. Концентрация цианида водорода 2000 ppm (около 2380 мг / м 3 ) убьет человека примерно за одну минуту. Токсический эффект вызван действием иона цианида, который останавливает клеточное дыхание . Он действует как неконкурентный ингибитор фермента в митохондриях, называемого цитохром-соксидазой . Таким образом, цианистый водород обычно входит в список химического оружия как агент крови .
В Конвенции о запрещении химического оружия списков его под Списком 3 в качестве потенциального оружия , которое имеет крупные промышленные применения. Подписавшие страны должны декларировать заводы-производители, которые производят более 30 метрических тонн в год, и разрешать инспекции со стороны Организации по запрещению химического оружия .
Пожалуй, самое позорное использование Циклон Б ( на немецком языке : Cyclone B с B стоя на Blausäure — синильная кислота, а также, чтобы отличить его от более раннего продукта позже известным как Циклон А), он использовался в нацистской Германии концентрационных лагерях во время мира Война II на массовые убийства в рамках их программы геноцида « Окончательное решение ». Цианистый водород также использовался в лагерях для дезинфекции одежды в попытках искоренить болезни, переносимые вшами и другими паразитами. Один из первых чешских производителей до недавнего времени продолжал выпускать Циклон Б под торговой маркой «Ураган Д2».
Цианистый водород также использовался в судебных казнях в некоторых штатах США , где он был получен во время казни действием серной кислоты на цианид натрия или калия .
Под названием синильной кислоты , HCN используется в качестве успокоительного средства в китобойных гарпунов, хотя это оказалось весьма опасным для экипажа развертывает его, и быстро отказались. С середины 18 века его использовали при отравлении, убийствах и самоубийствах.
Цианистый водород в воздухе взрывоопасен при концентрациях выше 5,6%. Эта концентрация намного выше токсичного уровня.
Получение[править | править код]
В настоящий момент существуют три наиболее распространённых метода получения синильной кислоты в промышленных масштабах:
Метод .mw-parser-output .ts-comment-commentedText{border-bottom:1px dotted;cursor:help}@media(hover:none){.mw-parser-output .ts-comment-commentedText:not(.rt-commentedText){border-bottom:0;cursor:auto}}Андрусова — прямой синтез из аммиака и метана в присутствии воздуха и платинового катализатора при высокой температуре:
Метод BMA (Blausäure aus Methan und Ammoniak), запатентованный фирмой Degussa: прямой синтез из аммиака и метана без воздуха в присутствии платинового катализатора при высокой температуре:
- Побочный продукт при производстве акрилонитрила путём окислительного аммонолиза пропилена.
- Реакцией цианида калия с водой и диоксидом углерода:
Термическим разложением железосинеродистой и железистосинеродистой кислот:
В Шавиниганском процессе углеводороды (например, пропан) реагируют с аммиаком. В лаборатории небольшие количества синильной кислоты образуются путём добавления кислот к цианидным солям щелочных металлов:
Эта реакция иногда является основой случайных отравлений, потому что кислота превращает нелетучую цианидную соль в газообразный циановодород.
Реакцией монооксида углерода с аммиаком:
Фотолиз метана в бескислородной атмосфере:
Использование водорода в металлургии
С помощью водорода удается восстановить первоначальные свойства определенных металлов, состоящих из их оксидов (вольфрам). При его горении в кислороде достигается температура в среднем 3000 °C. Данные условия позволяют выполнять плавление и сваривание металлов тугоплавкого типа.
Использование водорода в промышленности можно наблюдать на примере металлургии. данной отрасли он задействуется с целью восстановительного процесса металлов из оксидов. В результате удается получить сплавы, относящиеся к тугоплавким. Затем водородно-кислородное пламя, отличающееся высокой температурой, обладает способностью расплавлять их и сваривать. Для таких целей задействуется горелка, спроектированная по аналогии ацетиленокислородной.
Наша продукция
Преимущества применения водорода
Водород, пребывающий в жидком состоянии, является отличным вариантом топлива для ракет. Также активно идет работа, чтобы в будущем использовать его в виде горючего для силового агрегата машин. Воплощение в жизнь данной идеи положительно скажется на экологической ситуации, так как при сгорании водорода в атмосферу не попадают опасные компоненты, наносящиеся непоправимый вред окружающей среде.
Одним из основных потребителем химического элемента являются предприятия, работающие в сфере нефтехимии и занимающиеся переработкой нефти. Здесь расход водорода, который добывается промышленным методом, достигает отметки 50% от общего числа. Большое количество полимеров, соединений углеводородного типа и масс, с пластическими свойствами, получают исключительно из водорода.
Газообразное вещество благодаря отличной теплопроводности и отсутствию в составе вредных компонентов оптимально подходит для снижения уровня нагрева турбогенераторов, характеризующихся высоким запасом мощности. В условиях повышенной температуры водород демонстрирует регенерацию, беря на себя атомы кислорода, находящиеся в оксидах металлов. Это дает возможность применять его для прямого восстановления руды.
В зависимости от отрасли газообразная консистенция выступает как основной элемент, дополнительный материал либо горючее.
Cогласно статистическим данным востребованность водорода стремительно растет и его использование каждые 15 лет удваивается в несколько раз.
Токсичность и биологические свойства
Синильная кислота — сильнейший яд общетоксического действия, блокирует клеточную цитохромоксидазу, в результате чего возникает выраженная тканевая гипоксия. Половинные летальные дозы (LD50) и концентрации для синильной кислоты:
- Мыши:
- перорально (ORL-MUS LD50) — 3,7 мг/кг;
- при вдыхании (IHL-MUS LC50) — 323 м.д.;
- внутривенно (IVN-MUS LD50) — 1 мг/кг.
- Кролики, внутривенно (IVN-RBT LD50) < 1 мг/кг;
- Человек, минимальная опубликованная смертельная доза перорально (ORL-MAN LDLo) < 1 мг/кг.
При вдыхании синильной кислоты в небольших концентрациях наблюдается царапанье в горле, горький вкус во рту, головная боль, тошнота, рвота, боли за грудиной. При нарастании интоксикации уменьшается частота пульса, усиливается одышка, развиваются судороги, наступает потеря сознания. При этом цианоз отсутствует (содержание кислорода в крови достаточное, нарушена его утилизация в тканях).
При вдыхании синильной кислоты в высоких концентрациях или при попадании её внутрь появляются клонико-тонические судороги и почти мгновенная потеря сознания вследствие паралича дыхательного центра. Смерть может наступить в течение нескольких минут.
В организме человека метаболитом синильной кислоты является роданид (тиоцианат) SCN−, образующийся при её взаимодействии с серой под действием фермента роданазы.
Примечания
- ↑
- ↑
- Обычно под синильной кислотой в химии подразумевается водный раствор цианистого водорода, поэтому отождествление синильной кислоты с самим цианистым водородом, хотя и широко распространено, не вполне корректно.
- ↑ Смирнов С. К. Синильная кислота // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные—Трипсин. — С. 352. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- . Online Mendelian Inheritance in Man. Дата обращения: 31 марта 2010.
- , с. 26.
- , с. 520.
- ↑
- P.Clarke, L.Hardy, A.Williams «Executioners», London, 2008, page 493 (ISBN 978-0-70880-491-9)
- МКХБ Международная организация труда. . www.ilo.org/dyn/icsc/ (2018). Дата обращения: 12 ноября 2019.
- Braker W. and A.L. Mossman. Matheson Gas Data Book (англ.). — 6th edition. — Basking Ridge, NJ: Matheson Gas, Lyndhurst, 1980. — 711 p.
Применение
В химическом производстве
Является сырьём для получения акрилонитрила, метилметакрилата, адипонитрила и других соединений. Синильная кислота и большое число её производных используются при извлечении благородных металлов из руд, при гальванопластическом золочении и серебрении, в производстве ароматических веществ, химических волокон, пластмасс, каучука, органического стекла, стимуляторов роста растений, гербицидов.
Как отравляющее веществo
Впервые в роли боевого отравляющего вещества синильная кислота была использована французской армией 1 июля 1916 года на реке Сомме. Однако из-за отсутствия кумулятивных свойств и малой стойкости на местности её последующее использование в этом качестве прекратилось.
Синильная кислота являлась основной составляющей препарата «Циклон Б», который был наиболее популярным в Европе во время Второй мировой войны инсектицидом, а также использовался нацистами для убийства людей в концентрационных лагерях. В некоторых штатах США синильная кислота использовалась в газовых камерах в качестве отравляющего вещества при исполнении приговоров смертной казни; в последний раз это было сделано в Аризоне в 1999 году. Смерть, как правило, наступает в течение 5—15 минут.
Это интересно: Биодеградация — рассматриваем развернуто
Лечение
Лечение отравлений синильной кислотой проводится в условиях стационара. Во всех случаях терапия интоксикации цианистым водородом проводится под круглосуточным врачебным наблюдением, включая и те случаи, когда пострадавшему стало значительно лучше после оказания первой медицинской помощи.

Пациенту проводится внутривенное или внутримышечное введение Тиосульфата натрия, глюкозы, Этилнитрита, Амилнитрита и азотнокислого натрия. Для восстановления полноценной дыхательной функции больному делаются ингаляции кислорода, вводятся средства, являющиеся стимуляторами дыхательной активности. К ним относятся Лобелин и Цититон.
В случае резкого падения артериального давления, которое часто сопровождает отравление синильной кислотой, пострадавшему назначают лекарственные препараты Кофеин, Эфедрин, Кордиамин, Адреналин.
История
Впервые хлороводород получил алхимик Василий Валентин, нагрев гептагидрат сульфата железа с поваренной солью и назвав полученное вещество «духом соли» (лат. spiritus salis). Иоганн Глаубер в XVII в. получил соляную кислоту из поваренной соли и серной кислоты. В 1790 году британский химик Гемфри Дэви получил хлороводород из водорода и хлора, таким образом установив его состав. Возникновение промышленного производства соляной кислоты связано с технологией получения карбоната натрия: на первой стадии этого процесса поваренную соль вводили в реакцию с серной кислотой, в результате чего выделялся хлороводород. В 1863 году в Англии был принят закон «Alkali Act», согласно которому запрещалось выбрасывать этот хлороводород в воздух, а необходимо было пропускать его в воду. Это привело к развитию промышленного производства соляной кислоты. Дальнейшее развитие произошло благодаря промышленным методам получения гидроксида натрия и хлора путём электролиза растворов хлорида натрия.
Получение
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
СН4 + 2Н20 = CO2 + 4Н2 — 165 кДж
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который применяется иногда и в промышленности,- разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
В промышленности
1.Электролиз водных растворов солей:
- 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
- H2O + C ⇄ H2 + CO
3.Из природного газа.
- Конверсияс водяным паром:
- CH4 + H2O ⇄ CO + 3H2 (1000 °C)
- Каталитическое окисление кислородом:
- 2CH4 + O2 ⇄ 2CO + 4H2
4. Крекинг и реформинг углеводородов в процессе переработки нефти.
В лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и соляную кислоту:
- Zn + 2HCl → ZnCl2 + H2↑
2.Взаимодействие кальция с водой:
- Ca + 2H2O → Ca(OH)2 + H2↑
3.Гидролиз гидридов:
- NaH + H2O → NaOH + H2↑
4.Действие щелочей на цинк или алюминий:
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
- Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
- 2H3O+ + 2e- → H2↑ + 2H2O
Биореактор для производства водорода
Особенности обращения
Соляная кислота относится к веществам III класса опасности (ГОСТ 12.1.007-76). Рекомендуемая ПДК в рабочей зоне — 5 мг/м³.
Высококонцентрированная соляная кислота представляет собой едкое вещество. При попадании на кожу вызывает сильные химические ожоги. Особенно опасным считается попадание в глаза (в значительном количестве). Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно пищевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен.
Биологическая роль
Показано, что нейроны способны вырабатывать эндогенную синильную кислоту (цианистый водород, HCN) после их активации эндогенными или экзогенными опиоидами и что образование нейронами эндогенной синильной кислоты повышает активность NMDA-рецепторов и, таким образом, может играть важную роль в передаче сигнала между нейронами (нейротрансмиссии). Более того, образование эндогенного цианида оказалось необходимым для проявления в полном объёме анальгетического действия эндогенных и экзогенных опиоидов, а вещества, снижающие образование свободной HCN, оказались способны уменьшать (но не полностью устранять) анальгетическое действие эндогенных и экзогенных опиоидов. Выдвинуто предположение, что эндогенная синильная кислота может являться нейромодулятором.
Известно также, что стимуляция мускариновых холинорецепторов клеток феохромоцитомы в культуре повышает образование ими эндогенной синильной кислоты, однако стимуляция мускариновых холинорецепторов ЦНС в живом организме крысы приводит, наоборот, к снижению образования эндогенной синильной кислоты.
Также показано, что синильная кислота выделяется лейкоцитами в процессе фагоцитоза и способна убивать патогенные микроорганизмы.
Возможно, что вазодилатация, вызываемая нитропруссидом натрия, связана не только с образованием окиси азота (механизм, общий для действия всех сосудорасширяющих препаратов группы нитратов, таких как нитроглицерин, нитросорбид), но и с образованием цианида. Возможно, что эндогенный цианид и образующийся при его обезвреживании в организме тиоцианат играют роль в регуляции функций сердечно-сосудистой системы, в обеспечении вазодилатации и являются одними из эндогенных антигипертензивных веществ.
Физические свойства
Смешивается во всех соотношениях с водой, этанолом, диэтиловым эфиром. Смешивается также со многими другими спиртами и эфирами, ароматическими углеводородами и тетрахлоруглеродом.
Молекула HCN имеет линейное строение с межатомными расстояниями H—C 0,1064 нм и C≡N 0,1156 нм и сильно полярна (электрический дипольный момент μ = 0,992⋅10−29 Кл·м).
Безводный цианистый водород является сильно ионизирующим растворителем, растворённые в нём электролиты хорошо диссоциируют на ионы. Его относительная диэлектрическая проницаемость при 25 °C равна 106,8 (выше, чем у воды). Это обусловлено линейной ассоциацией полярных молекул HCN за счёт образования водородных связей.
Температура плавления −13,29 °C, кипения +25,65 °C. Плотность 0,71618 г/см3 при 0 °C, 0,68708 г/см3 при 0 °C.
Критическое давление 4,95 МПа, критическая температура +183,5 °C, критическая плотность 0,195 г/см3.
Коэффициент преломления nD = 1,26136 (20 °C).
Энтальпия образования 132 кДж/моль, энтальпия плавления 8,41 кДж/моль, энтальпия испарения 25,2 кДж/моль. Энтальпия сгорания −663 кДж/моль. Энтропия 201,71 Дж/(моль·К) (при 298 К).
Динамическая вязкость 0,183 мПа·с, кинематическая вязкость 17,78 мН/м.
Удельное электрическое сопротивление жидкой синильной кислоты 105 Ом·м.
Твёрдая синильная кислота при нормальном давлении существует в двух кристаллических модификациях. При температуре ниже −102,78 °C образует кристаллы ромбической сингонии, пространственная группа I2mm, параметры ячейки a = 0,413 нм, b = 0,485 нм, c = 0,434 нм, Z = 2. Выше этой температуры переходит в кристаллы тетрагональной сингонии, пространственная группа I4mm, параметры ячейки a = 0,463 нм, c = 0,434 нм, Z = 2.
Физиологические свойства[править | править код]
Синильная кислота является веществом, вызывающим кислородное голодание тканевого типа. При этом наблюдается высокое содержание кислорода как в артериальной, так и в венозной крови и уменьшение таким образом артерио-венозной разницы, резкое понижение потребления кислорода тканями с уменьшением образования в них углекислоты. Синильная кислота и её соли, растворённые в крови, достигают тканей, где вступают во взаимодействие с трёхвалентной формой железа цитохромоксидазы. Соединившись с цианидом, цитохромоксидаза теряет способность переносить электроны на молекулярный кислород. Вследствие выхода из строя конечного звена окисления блокируется вся дыхательная цепь и развивается тканевая гипоксия. С артериальной кровью кислород доставляется к тканям в достаточном количестве, но не усваивается ими и переходит в неизмененном виде в венозное русло. Одновременно нарушаются процессы образования макроэргов, необходимых для нормальной деятельности различных органов и систем. Активизируется гликолиз, то есть обмен с аэробного перестраивается на анаэробный. Также подавляется активность и других ферментов — каталазы, пероксидазы, лактатдегидрогеназы.
Действие на нервную системуправить | править код
В результате тканевой гипоксии, развивающейся под влиянием синильной кислоты, в первую очередь нарушаются функции центральной нервной системы.
Действие на дыхательную системуправить | править код
В результате острого отравления наблюдается резкое увеличение частоты и глубины дыхания. Развивающуюся одышку следует рассматривать как компенсаторную реакцию организма на гипоксию. Стимулирующее действие синильной кислоты на дыхание обусловлено возбуждением хеморецепторов каротидного синуса и непосредственным действием яда на клетки дыхательного центра. Первоначальное возбуждение дыхания по мере развития интоксикации сменяется его угнетением вплоть до полной остановки. Причинами этих нарушений являются тканевая гипоксия и истощение энергетических ресурсов в клетках каротидного синуса и в центрах продолговатого мозга.
Действие на сердечно-сосудистую системуправить | править код
Проникая в кровь, синильная кислота снижает способность клеток воспринимать кислород из притекающей крови. А так как нервные клетки больше остальных нуждаются в кислороде, они первыми страдают от её действия. В начальном периоде интоксикации наблюдается замедление сердечного ритма. Повышение артериального давления и увеличение минутного объёма сердца происходят за счёт возбуждения синильной кислотой хеморецепторов каротидного синуса и клеток сосудодвигательного центра с одной стороны, и выброса катехоламинов из надпочечников и вследствие этого спазма сосудов — с другой. В дальнейшем артериальное давление падает, пульс учащается, развивается острая сердечно-сосудистая недостаточность и наступает остановка сердца.
Изменения в системе кровиправить | править код
Содержание в крови эритроцитов увеличивается, что объясняется рефлекторным сокращением селезёнки в ответ на развивающуюся гипоксию. Цвет венозной крови становится ярко-алым за счёт избыточного содержания кислорода, не поглощённого тканями. Артерио-венозная разница по кислороду резко уменьшается. При угнетении тканевого дыхания изменяется как газовый, так и биохимический состав крови. Содержание CO2 в крови снижается вследствие меньшего образования и усиленного его выделения при гипервентиляции. Это приводит в начале развития интоксикации к газовому алкалозу, который меняется метаболическим ацидозом, что является следствием активации процессов гликолиза. В крови накапливаются недоокисленные продукты обмена. Увеличивается содержание молочной кислоты, нарастает содержание ацетоновых тел, отмечается гипергликемия. Нарушение окислительно-восстановительных процессов в тканях приводит к гипотермии. Таким образом, синильная кислота и её соли вызывают явления тканевой гипоксии и связанные с ней нарушения дыхания, кровообращения, обмена веществ, функции центральной нервной системы, выраженность которых зависит от тяжести интоксикации.
Вхождение
В природе
Удаление цианида из маниоки в Нигерии .
Цианиды производятся некоторыми бактериями , грибами и водорослями . Это антифидант ряда растений. Цианиды содержатся в значительных количествах в некоторых семенах и косточках плодов, например горького миндаля , абрикосов , яблок и персиков . Химические соединения, которые могут выделять цианид, известны как цианогенные соединения. В растениях цианиды обычно связаны с молекулами сахара в форме цианогенных гликозидов и защищают растение от травоядных . Корни маниоки (также называемые маниока), важная пища, похожая на картофель, выращиваемая в тропических странах (и основа, из которой сделана тапиока ), также содержат цианогенные гликозиды.
Мадагаскар бамбук Cathariostachys madagascariensis производит цианид в качестве сдерживающего фактора для выпаса скота. В ответ на это у золотистого бамбукового лемура , который ест бамбук, развилась высокая толерантность к цианиду.
Межзвездная среда
Цианистый радикал · CN , был идентифицирован в межзвездном пространстве . Cyanogen , (CN) 2 , используется для измерения температуры межзвездных газовых облаков .
Продукты пиролиза и горения
Цианистый водород образуется при сжигании или пиролизе определенных материалов в условиях дефицита кислорода . Например, его можно обнаружить в выхлопе двигателей внутреннего сгорания и табачном дыме. Некоторые пластмассы , особенно полученные из акрилонитрила , выделяют цианистый водород при нагревании или горении.
Кофактор
В гидрогеназах ферментов содержат цианид лиганды , прикрепленные к железу в их активных центрах. Биосинтез цианида в -hydrogenases поступления от карбамоильного фосфата , который преобразует в Цистеиниловый тиоцианат , КН — донор.
Органические производные
В IUPAC номенклатуре , органические соединения , которые имеют -C≡N функциональной группы , называются нитрилы . Примером нитрила является ацетонитрил CH 3 CN . Нитрилы обычно не выделяют ионы цианида. Функциональная группа с гидроксилом и цианидом, связанными с одним и тем же углеродом, называется циангидрином . В отличие от нитрилов, циангидридины выделяют цианистый водород . В неорганической химии соли, содержащие ион C≡N — , называют цианидами . Хотя цианид-ион содержит атом углерода, он обычно не считается органическим.