Продукты горения (сгорания)
Содержание:
- Минеральные примеси
- Что такое горение и его продукт?
- Теория горения
- Применение органических веществ
- Описание процесса горения
- Отравление
- Народные способы определения
- Вторичные факторы опасности при пожаре
- Происхождение
- Самые опасные продукты горения
- Что выделяется при горении дерева?
- Продукты горения углеводородов
- Продукты горения древесины
- Количество диоксида углерода в продуктах сгорания газа
- Действие на организм человека
- Горение условия горения и польза для человека
- Приведенные характеристики
- Термическое разложение
- Классы опасности
- Что образуется в процессе горения
Минеральные примеси
Во всех видах твердого топлива имеются минеральные примеси, в основном состоящие из следующих соединений:
- силикаты;
- сульфиды;
- углекислые соли Ca, Mg и Fe;
- фосфаты;
- хлориды;
- сульфаты кальция и железа.
В процессе горения органического топлива они подвергаются высокотемпературной трансформации, в результате которой остается твердая негорючая зола. Ее состав сильно отличается от исходных веществ из-за следующих реакций:
- превращение окисных солей железа в оксиды;
- дегидратация силикатных соединений;
- разложение карбонатов, выделение CO2, образование оксидов;
- окисление сернистых соединений, выделение сернистого газа;
- испарение солей щелочных металлов.
Конечный состав зольного остатка зависит от условий сжигания органического топлива. При высоких температурах он может расплавиться и перейти в жидкое состояние (шлак). Часть золы удаляется из топок вместе с летучими продуктами сгорания, что приводит к загрязнению, зашлаковыванию и коррозионному износу топочного оборудования.
Что такое горение и его продукт?
Бесконечно можно смотреть на три вещи: как течет вода, как работают другие люди и, конечно, как горит огонь…
Горение – это физико-химический процесс, основой которого является окислительно-восстановительная реакция. Сопровождается она, как правило, выбросом энергии в виде огня, тепла и света. В этом процессе принимают участие вещество или смесь веществ, которые горят, – восстановители, а также окислитель. Чаще всего эта роль принадлежит кислороду
Горение также можно назвать процессом окисления горящих веществ (важно помнить, что горение – подвид реакций окисления, а не наоборот)

Продукты горения – это все то, что выделяется во время сжигания. Химики в таких случаях говорят: “Все, что находится в правой части уравнения реакции”. Но это выражение неприменимо в нашем случае, так как, кроме окислительно-восстановительного процесса, происходят также и реакции разложения, а некоторые вещества просто остаются неизменными. То есть продуктами горения являются дым, зола, копоть, выделяемые газы, в том числе и выхлопные. Но особым продуктом является, конечно, энергия, которая, как отмечено в прошлом абзаце, выбрасывается в виде тепла, света, огня.
Теория горения
Суть процесса горения, несмотря на большой практический опыт и применение, исследовалась в течение многих лет и остается одной из самых сложных загадок человечества. Наука, изучающая явление горения, является междисциплинарной и располагается на стыке газодинамики, химической термодинамики, химкинетики, молекулярной и химической физики, а также материаловедения и моделирования с использованием компьютерных технологий.
Рассмотрим следующие положения теории горения: полноту сгорания и его термодинамический механизм. Положение полноты сгорания включает в себя информацию о том, что исходные компоненты горючих смесей характеризуются молярной и массовой долей элемента, а также начальными показателями давления и температуры. Подобрав вещество, способное в ходе сгорания и окисления полностью превратиться в продукт рассматриваемого явления, можно получить стехиометрическую реакцию. Смесь, обладающая избытком горючего вещества, что не может полностью разложиться из-за нехватки окислителей, именуется богатой. Вещество с нехваткой топливного ресурса называют бедным.
Термодинамические данные позволяют нам утверждать, что горение, протекающее адиабатическим путем при наличии постоянного показателя объема, сохранит полную энергию внутренней системы. Если имеется постоянное давление, то наблюдается энтальпия структурных компонентов. Условия, при которых протекает адиабатическое давление, практически применяются и реализуются в пламени, что распространяется свободными путями. При этом расчетом теплопотери пренебрегают.
Применение органических веществ
Органические вещества – это класс химических соединений, объединяющий все вещества, в состав которых входит углерод.
Алканы
Предельные (насыщенные) углеводороды, атомами водорода: СН4 – метан (основа природного газа), С2Н6 – этан, С3Н8 – пропан, С8Н18 – октан (основа бензина).
- Применяются в качестве топлива: бензин, дизельное, авиационное, пропан-бутановая смесь для бытовых плит.
- Вазелин – незаменим в медицине, парфюмерии, косметологии.
- Входят в состав смазочных масел.
- Хладагент для холодильников.
- Петролейный эфир и циклогексан используются в качестве растворителя.
- Метан незаменимый компонент при производстве шин.
Широко распространено применение данной группы органических соединений в химической промышленности (для производства пластмасс, синтетических волокон и т.д.) и медицине.
Алкены
Соединения служат исходными веществами для получения ряда готовых продуктов:
- растворителей (спиртов, дихлорэтана, эфира);
- полимеров (полиэтилена, поливинилхлорида, полиизобутилена);
Этилен (Н2С=С Н2) используется для получения, тефлона, этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
Алкены применяются и для ускорения процесс созревания фруктов.
Алкины (ацетиленовые углеводороды)
Ацетилен – необходим в качестве исходного продукта в органическом синтезе при производстве:
- полимеров (каучука, поливинилхлорида и др.);
- растворителей (1,1,2,2-тетрахлорэтана , 1,1,2-трихлорэтена);
- уксусной кислоты.
Температура пламени вещества достигает 3150°С, что нашло свое применение при резке металла и в сварке.
Спирты
Алкоголи – производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу ОН.
Метанол (СН3ОН) –применяется в производстве муравьиной кислоты и формальдегида. Рассматривается как вариант для применения в качестве моторного топлива.
Этанол (С2Н5ОН)- востребован в виде исходного соединения для получения уксусной кислоты, сложных эфиров, карбоновых кислот. Вещество служит основой производства спиртосодержащей продукции и антисептических средств.
Этиленгликоль – компонент необходимый в производстве пластмасс, антифризов, органическом синтезе.
Глицерин – незаменим в разных отраслях промышленности, в том числе текстильной, пищевой, фармакологии.
Фенолы
Основное использование соединений приходится на химическую промышленность, медицину (производство синтетических смол, красителей, антисептиков, взрывчатых веществ и т.д.).
Альдегиды
Метаналь – используется при получении фенолформальдегидных и карбамидных смол, синтезе лекарственных средств, как дезинфицирующее средство.
Этаналь — нашел свое применение в органическом синтезе.
Карбоновые кислоты
Соединения, карбоксильной группы –СООН.
Муравьиная кислота (НСООН) –применяется в фармацевтической и пищевой промышленности. Уксусная кислота (СН3СООН) — востребована для производства искусственных волокон на основе целлюлозы и в пищевой промышленности.
Бензойная кислота (С6Н5СООН) – незаменима в фармацевтике для синтеза душистых веществ и красителей, а также в качестве консерванта для пищевых продуктов.
Сложные эфиры
Применяются в пищевой и парфюмерной отраслях в качестве отдушек. А также обеспечивают эластичность и пластичность пластмасс и резины.
Также широко распространено в пищевой промышленности, медицине применение глюкозы, аминов, аминокислот. Целлюлоза основной компонент при изготовлении бумаги, пленок, искусственных волокон и т.д.
Много соединений еще не изучено до конца, и возможно, благодаря науке человек сможет заменить натуральные продукты на искусственные, органических соединений природного происхождения применяется все меньше.
Смотри также:
- Понятие о металлургии: общие способы получения металлов
- Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
- Природные источники углеводородов, их переработка
- Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
Описание процесса горения
В процессе горения древесины отмечается несколько этапов:
- Разогрев – происходит при температуре не менее 150 градусов по Цельсию и в присутствии наружного источника огня.
- Воспламенение – необходимая температура от 450 до 620 градусов по Цельсию в зависимости от влажности и плотности древесины, а также от формы и количества дров.
- Горение – состоит из двух фаз: пламенной и тления. Некоторое время оба вида протекают одновременно. После прекращения образования газов горит (тлеет) только уголь.
- Затухание – возникает при прекращении подачи кислорода или когда заканчивается топливо.

Плотная древесина горит медленнее, чем менее плотная вследствие того, что имеет большую теплопроводность. При горении сырых дров много тепла затрачивается на испарение влаги, поэтому они горят медленнее сухих дров. Горение древесины — это физическое или химическое явление? Этот вопрос имеет практическое значение, и от правильной его интерпретации будут зависеть условия максимальной теплоотдачи и длительности горения. С одной стороны, это химическое явление: при горении дров происходит химическая реакция и образуются новые вещества – оксиды, выделяется тепло и свет. С другой, – физическое: во время процесса происходит увеличение кинетической энергии молекул. В итоге получается, что процесс горения древесины – это сложное физико-химическое явление. Знакомство с ним поможет правильно подобрать породы древесины, чтобы обеспечить себя длительным и устойчивым источником тепла.
Отравление
Некоторые вещества, выбрасываемые в атмосферу при окислении горючего, токсичны. Отравление продуктами горения – вполне реальная угроза не только при пожаре, но и в автомобиле. Кроме того, вдыхание или другой способ попадания некоторых из них не приводит к мгновенному негативному результату, а напомнит об этом через некоторое время. К примеру, так ведут себя канцерогены.
Естественно, каждому нужно знать правила, предотвращающие негативные последствия. В первую очередь, это правила противопожарной безопасности, то есть то, что каждому ребенку рассказывают с самого раннего детства. Но, почему-то, часто бывает, что и взрослые, и дети просто забывают их.
Правила оказания первой помощи при отравлении многим тоже, скорее всего, знакомы. Но на всякий случай: самое главное, вынести отравившегося человека на свежий воздух, то есть отгородить от дальнейшего попадания токсинов в его организм. Но и нужно помнить, что существуют методы защиты от продуктов горения органов дыхания, поверхности тела. Это защитный костюм пожарных, противогазы, кислородные маски.
Защита от токсичных продуктов горения очень важна.
Народные способы определения
Итак: как в домашних условиях определить Лучшие способы рождены опытным путем и довольно эффективны. Первый из них: поджигание спирта. Наливаем в небольшие плошки опытные жидкости и поджигаем. Присматриваемся внимательно к цвету горящего огня (а гореть будет по любому, так как крепость — свыше 40 градусов) и сравниваем. Если полыхает синим пламенем — то перед нами этанол, и его можно употреблять в питьевых целях (конечно же, если там отсутствуют другие вредные примеси). Если горение сопровождается зеленым цветом огня, то это метанол. Этот довольно простой и эффективный метод, как в домашних условиях определить метиловый спирт, бесспорно, подействует, если перед нами раствор достаточно чистый. А сам способ основан на некотором различии в химическом составе жидкостей.
Вторичные факторы опасности при пожаре
Наряду с основными угрозами, стоит знать и учитывать вторичные, но не менее грозные для человеческой жизни.
Высокое напряжение
При повреждении токоведущих конструкций и сгорании изоляции кабелей и проводов, металлические части оборудования могут оказаться под напряжением.
Нельзя тушить водой оборудование, находящееся под напряжением.
Радиоактивные и токсичные компоненты
К вторичным факторам опасности при пожарах отнесёмслучаи разрушения технологических установок, стендов и агрегатов, предназначенных для производства, переработки и хранения химических и радиоактивных продуктов.
Существует целый ряд химикатов, на которые нельзя подавать воду при тушении. Например: азид свинца, магний, битум, калий, магний, селитра, негашёная известь, серный ангидрид и др.
Обрушение строений
Ввиду ослабления несущих конструкций — велика вероятность дальнейшего обрушения стен и зданий.
Пренебрегая осторожностью, легко пораниться об осколки стен, упавшие конструкции, остатки производственных линий и сгоревших вещей. Паника
Паника
Давно подмечено, что на выживание во время чрезвычайных ситуаций существенное влияние оказывает психологическое состояние.
При появлении реальной угрозы жизни, некоторые люди подвержены паническим состояниям. Паника может выражаться резкими, необдуманными действиями, либо наоборот — впадению в ступор.
В результате панических действий может возникнуть давка на выходах, что может привести к жертвам. Поэтому панические действия в состоянии стресса, является одним из многочисленных проявлений факторов опасности, сопутствующих пожарам.
Способы защиты людей и имущества

Подробно все требования к организации спасения жителей и имущества прописаны в Федеральном законе — это «Технический регламент о требованиях пожарной безопасности» от 22.07.2008 N 123-ФЗ (последняя редакция).
Согласно статье 52 этого закона, следует выделить основные способы защиты:
- проектирование зданий с учётом горючести и токсичности строительных материалов;
- размещение на видном месте плана эвакуации;
- устройство аварийных выходов;
- устройство пожарной сигнализации;
- аварийный слив горючих и ядовитых жидкостей при возникновении ЧС;
- противовзрывная защита;
- наличие огнетушителей, других первичных средств борьбы с огнём;
- применение систем автоматического пожаротушения;
- организация пожарной охраны.
Происхождение

Согласно научным представлениям, все виды органического топлива образовались из растительных остатков и микроорганизмов, которые существовали от 500 тыс. до 500 млн лет назад. Их накопление происходило в тех участках земной коры, которые были защищены от активного окисления (мелководные прибрежные зоны водоемов, болота, дно морей). Химический состав этих остатков включает 4 основных элемента:
- углеводы;
- лигнин (межклеточное вещество высших растений);
- жироподобные вещества (смолы, воски, эфиры глицерина);
- белки.
Остатки высших растений и мхов, скапливавшиеся на заболоченных участках суши, стали основой для образования гумолитов (ископаемых углей), а микроводорослей и бактерий на дне водоемов – сапропелитов. Под воздействием высокого давления и температуры происходило преобразование органического вещества (углефикация).
Гумолиты с малой степенью углефикации называют бурыми углями. При более высокой температуре гуминовые кислоты превращались в нейтральные гумины. В каменном угле наблюдается полное отсутствие гуминовых кислот.
В сапропелитах в мягких условиях преимущественно протекали процессы полимеризации непредельных углеводородов с образованием горючих сланцев, при перегонке дающих большое количество смолы, сходной по составу с нефтью. Метаморфозы сапропеля при высоких температурах и каталитическом участии горных пород привели к образованию смеси углеводородов в жидком и газообразном состоянии (нефть, природный, попутный газ).
Самые опасные продукты горения
Наибольшую опасность возникновения отравления при пожарах жилых помещений представляют следующие продукты горения:
- диоксид, оксид углерода — растительные натуральные волокна, синтетические ткани;
- аммиак, окислы азота — пластмассы;
- сероводород, двуокись серы — резиновые изделия;
- альдегиды — древесина;
- хлористый водород, фосген — линолеум, оконные профили, изоляция проводов;
- цианистый водород — шерсть, шёлк.
Большинство приведённых примеров связано с поступлением токсинов через дыхательные пути. При пожарах опасность пострадать от пламени не уступает риску отравления продуктами горения.
Что выделяется при горении дерева?
При сгорании дерева образуется дым, состоящий их твердых частиц (сажи) и газообразных продуктов горения. В их состав входят вещества, находящиеся в древесине. Продукты, выделяющиеся при сгорании дерева, состоят из азота, углекислого газа, паров воды, сернистого газа и окиси углерода, которая способна гореть дальше.

Подсчитано, что каждый килограмм древесины выделяет при сгорании примерно 800 г газообразных продуктов и 200 г угля. Состав продуктов горения древесины зависит и от условий, при которых происходит этот процесс. Он может быть:
- Неполный – происходит при недостаточном доступе кислорода. В результате горения выделяются вещества, которые способны вновь гореть. К ним относится: сажа, окись углерода и разные углеводороды.
- Полный – возникает при достаточном доступе кислорода. В результате горения образуются продукты – углекислый и сернистый газ, водяной пар, — которые не способны больше гореть.
Продукты горения углеводородов

Пропан — газообразное вещество, которое относится к группе алканов. В результате неполного горения образуется сажа и бесцветный токсичный газ — оксид углерода (СО). Попадая в кровь, угарный газ образует соединение с гемоглобином. Нарушается транспортная функция эритроцитов. Возникшая гипоксия вызывает поражение центральной нервной системы, различной степени тяжести — от головной боли до развития судорог, комы, остановки кровообращения.
Продукты горения бензина содержат отработанные газы. К ним относятся окись углерода, окислы азота, углеводороды, альдегиды, оксид серы, бензапирен, сажа. Наибольшую опасность представляют оксиды азота. Диоксид азота связывается с гемоглобином, образуя метгемоглобин. Нарушение транспорта кислорода блокирует тканевое дыхание. Угнетается сознание, развивается токсический отёк лёгкого. Действие монооксида азота сопровождается одышкой, рвотой, падением артериального давления.
Продукты горения древесины
Сжигание дров — самый древний способ получения огня и тепла. При их сгорании образуется дым, который содержит сажу, газообразные продукты, уголь. Соотношение компонентов зависит от условий сжигания и характеристики самой древесины.
При неполном сгорании дров образуются сажа, окись углерода, углеводороды. Неисправность печной тяги в домах, банях вызывает тяжёлое отравление угарным газом.
При полном окислении, ядовитых продуктов горения не образуется. Дрова превратятся в углекислый, сернистый газ и водяной пар.
Костёр — это контролируемое сжигание древесных или других материалов. Продукты его горения зависят от выбранного топлива. Внешне это можно заметить по цвету пламени и запаху дыма. Например, синий оттенок у огня появляется при образовании угарного газа. Неприятный запах сопровождает термическую деструкцию синтетических материалов.
Количество диоксида углерода в продуктах сгорания газа
Пользуясь данными таблицы и зная процентное содержание СO 2 в продуктах сгорания, можно легко определить качество сгорания газа и коэффициент избытка воздуха а. Для этого с помощыр газоанализатора следует определить количество СO 2 в продуктах сгорания газа и на полученную величину разделить значение СO 2max , взятое из таблицы. Так, например, если при сжигании газа в продуктах его сгорания содержится 10,2 % диоксида углерода, то коэффициент избытка воздуха в топке
α = CO 2max /CO 2 анализа = 11,8/10,2 = 1,15 .
Наиболее совершенный способ контроля поступления воздуха в топку и полноты его сгорания — анализ продуктов сгорания с помощью автоматических газоанализаторов. Газоанализаторы периодически отбирают пробу отходящих газов и определяют содержание в них диоксида углерода, а также сумму оксида углерода и несгоревшего водорода (СО + Н 2) в объемных процентах.
Если показания стрелки газоанализатора по шкале (СO 2 + Н 2) равны нулю, это значит, что горение полное, и в продуктах сгорания нет оксида углерода и несгоревшего водорода. Если стрелка отклонилась от нуля вправо, то в продуктах сгорания имеются оксид углерода и несгоревший водород, то есть происходит неполное сгорание. На другой шкале стрелка газоанализатора должна показывать максимальное содержание СO 2mах в продуктах сгорания. Полное сгорание происходит при максимальном проценте диоксида углерода, когда стрелка указателя шкалы СО + Н 2 находится на нуле.
Александр Павлович Константинов
Главный инспектор по контролю безопасности ядерно и радиационно опасных объектов. Кандидат технических наук, доцент, профессор Российской академии естествознания.
Кухня с газовой плитой часто бывает главным источником загрязнения воздуха всей квартиры
И, что очень важно, это касается большинства жителей России. Ведь в России 90% городских и свыше 80% сельских жителей пользуются газовыми плитами Хата, З
И.
Здоровье человека в современной экологической обстановке. — М. : ФАИР-ПРЕСС, 2001. — 208 с.
.
В последние годы появились публикации серьёзных исследователей о высокой опасности газовых плит для здоровья. Медики знают, что в домах, где установлены газовые плиты, жители болеют чаще и дольше, чем в домах с электроплитами. Причём речь идёт о множестве разных болезней, а не только о заболеваниях дыхательных путей. Особенно заметно снижение уровня здоровья у женщин, детей, а также у пожилых и хронически больных людей, которые больше времени проводят дома.
Профессор В. Благов не зря назвал применение газовых плит «широкомасштабной химической войной против собственного народа».
Действие на организм человека
Степень токсичности веществ связана с их физической и химической природой. Взаимодействуя с организмом, продукты горения вызывают патологические синдромы.
Международная классификация болезней десятого пересмотра МКБ-10 определяет отравление продуктами горения кодом Т59 – «Токсическое действие других газов, дымов и паров».
По механизму действия на человека отравляющие компоненты в составе дыма делятся на пять групп.
На эту тему ▼
Отравление угарным газом
Симптомы, первая помощь и профилактика
Вещества, которые вызывают поражение кожного покрова и слизистой оболочки. Симптомы такого отравления продуктами горения – зуд, жжение кожи и её воспаление, боль в области глаз, век, слезотечение, кашель. Примеры – пары дёгтя, сернистый газ, формальдегид.
Продукты горения, которые вызывают острые ингаляционные отравления. Пострадавшие жалуются на одышку, кашель
При осмотре обращает на себя внимание частое дыхание, синюшность. При высокой концентрации токсичного газа может произойти остановка дыхания
Так, признаки отравления продуктами горения ПВХ могут проявиться через несколько часов. Ингаляционные отравления вызывает хлор, аммиак, оксид азота.
Продукты горения с образованием токсичных веществ, которых называют «ядами крови». Связывая гемоглобин, они нарушают доступ кислорода к тканям и запускают патологические реакции, охватывающие весь организм. Примеры – угарный газ, диоксид азота.
Продукты горения, для которых органом-мишенью является нервная система. Это бензол, сероводород.
Ферментные яды, которые воздействуют на тканевое дыхание, блокируя процессы активации кислорода. Это сероводород, синильная кислота.
Многие токсины, образующие в продуктах горения «универсальны», так как вызывают поражение сразу нескольких систем организма.
Горение условия горения и польза для человека
1.3. ОСНОВНЫЕ ОБЛАСТИ ПРИМЕНЕНИЯ ГОРЕНИЯ
Процессы горения жидких, твердых и газообразных топлив широко используются практически во всех отраслях современной техники и технологии. Отметим наиболее важные направления использования процессов горения.
· Наиболее важную роль процессы горения играют в теплоэнергетике. Тепловые электростанции используют энергию горения угля, горючих газов, и жидких углеводородов.
· В технологии получения черных и цветных металлов, стекла, керамики, цемента, и других необходимых материалов также используется энергия горения для нагрева и плавления соответствующих компонентов и сырья.
· Артиллерия, стрелковое оружие и другие виды вооружений используют в качестве источника энергии взрывчатые вещества различных классов.
· Большое народнохозяйственное значение имеют взрывные технологии, применяемые для добычи угля и других полезных ископаемых, при строительных работах (возведение плотин, прокладка туннелей и т.д.), при разрушении ледяных заторов.
· Важным направлением в науке о горении являются экологические аспекты горения, получившие большое развитие в последнее время. К ним относятся технология сжигания бытовых отходов, изучение механизмов образования экологически вредных продуктов сгорания (оксиды азота, сажа, соединения хлора). Эти исследования позволяют найти условия, при которых концентрация токсичных веществ в выбросах минимальна.
· Одним из важнейших направлений науки о горении является изучение пожаров (в жилых помещениях, лесных массивов и т.д.) и разработка методов пожаротушения. Для тушения пожаров используются как физические, так и химические способы, которые способствуют обрыву цепей химической реакции горения.
· Отдельно следует отметить роль процессов горения в двигателестроении, авиации и ракетной технике. Процессы горения используются для получения движущей энергии различных транспортных средств, начиная от паровоза и вплоть до современных ракетных двигателей, автомобилей, самолетов, судов и т.д. В качестве примера рассмотрим схему прямоточного воздушно-реактивного двигателя, приведенную на рис. 1.1.
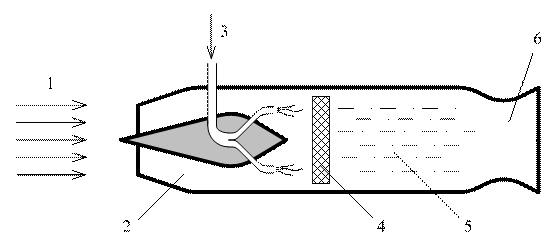
Рис. 1.1. Схема прямоточного воздушно-реактивного двигателя:
1 – воздух; 2 – диффузор; 3 – впрыск горючего;4 – стабилизатор пламени;
5 – камера сгорания; 6 – сопло
Помимо жидкостных ракетных двигателей, в которых в качестве горючего используются несимметричный диметилгидразин (гептил) или жидкий водород, а в качестве окислителя – азотная кислота или жидкий кислород, в СССР, США, Японии, Китае, Западной Европе получили развитие ракетные двигатели на твердом топливе. В качестве твердого топлива, способного к самостоятельному горению, чаще всего используется смесь полимерного горючего и порошкообразного окислителя, например, перхлората аммония. Основной задачей при создании топлива является получение наиболее высокого удельного импульса (отношение тяги двигателя к массовому секундному расходу топлива), достигаемого при наиболее высокой температуре и наименьшем молекулярном весе продуктов сгорания. С этой целью в состав твердых ракетных топлив добавляют порошки легких металлов – алюминия или магния. Изучение горения таких сложных систем представляет серьезную задачу в современной физике горения.
Наука о горении продолжает развиваться. В последние годы появились новые направления в науке о горении и технологии, основанные на нем. Это самораспространяющийся высокотемпературный синтез – процесс перемещения волны химической реакции по смеси твердых дисперсных реагентов с образованием твердых конечных продуктов. Данная технология позволяет синтезировать новые материалы и вещества с особыми свойствами. Можно назвать еще целый ряд технологий, число которых постоянно пополняются, где процессы горения и взрыва играют определяющую роль.
Несмотря на длинную историю, количественное описание процессов горения стало развиваться сравнительно недавно. Это связано со сложностью явления, которое включает в себя целый ряд химических реакций, а также такие аспекты, как течение газа, теплопроводность и диффузионный перенос веществ. В последние годы экспериментальная техника и техника компьютерного моделирования поднялись до такого высокого уровня, что многие проблемы горения могут быть описаны количественно.
Приведенные характеристики
Для сравнительного анализа свойств различных типов топлива используют приведенные характеристики, определяемые как отношение показателя качества рабочего топлива к его удельной низшей теплоте сгорания.
Основными приведенными расчетными показателями служат:
- влажность;
- зольность;
- содержание серы и азота.
В топливно-энергетической промышленности для сравнения эффективности применяемого топлива применяется также понятие условного топлива. Оно представляет собой горючее, у которого низшая удельная теплота сгорания в рабочем состоянии составляет 7000 ккал/кг. Для каждого вида топлива можно рассчитать безразмерный тепловой коэффициент в виде отношения собственной удельной теплоты сгорания к этой величине для условного топлива.
При полном сгорании органического топлива образуются трехатомные газы (углекислый и сернистый газ) и вода. Расход веществ (для 1 моля горючего), участвующих при сжигании, вычисляют по формулам исходя из условия, что прореагирует весь кислород, поданный вместе с воздухом. Такие уравнения называют материальным балансом горения.
В реальных условиях расчетные значения корректируют с помощью коэффициентов, так как для полного сжигания всегда требуется больше воздуха. Для определения температуры продуктов сгорания составляют тепловой баланс реакции окисления (в расчете на 1 кг жидкого или твердого органического топлива или на 1 м3 для газообразного). С точки зрения физики уравнение теплового баланса является не чем иным, как формой записи закона сохранения энергии.
Термическое разложение

Твердое органическое топливо при сжигании проходит несколько стадий разложения:
- бертинирование (температура до 300 °С, выделяются углекислый и угарный газ, водород и углеводороды, пирогенетическая вода);
- полукоксование (400-450 °С, выделяется основной объем горючего газа);
- коксование (700-1100 °С, завершение процесса выхода летучих соединений).
Продукты сгорания органического топлива соответственно называют бертинатами, полукоксами, коксами.
Наименьшая теплота сгорания у высокозольных сланцев, влажного торфа и бурого угля, а наибольшая – у антрацитов. Низшая теплота сгорания, при которой водяные пары выходят в атмосферу, а не конденсируются, у твердых видов топлива составляет 4,6-26 МДж/кг.
Классы опасности
Классификация горючих строительных материалов по значению показателя токсичности продуктов горения приводится в таблице № 2 ГОСТ 12.1.044-89.
Показатель токсичности продуктов горения – это отношение количества материала к единице объема замкнутого пространства, в котором образующиеся при горении материала газообразные продукты вызывают гибель 50% подопытных животных.
| Класс опасности | HCL50, г × м
-3 , при времени экспозиции, мин |
|||
| 5 | 15 | 30 | 60 | |
| Чрезвычайно опасные | До 25 | До 17 | До 13 | До 10 |
| Высокоопасные | 25-70 | 17-50 | 13-40 | 10-30 |
| Умеренно опасные | 70-210 | 50-150 | 40-120 | 30-90 |
| Малоопасные | Свыше 210 | Свыше 150 | Свыше 120 | Свыше 90 |
Что образуется в процессе горения
В основе лежит химическая реакция окисления. Её результат — образование веществ различного физического состояния, которые называют продуктами горения.
В состав топлива входят органические соединения. Опасность продуктов их горения зависит от природы вещества и условий его сжигания. Часть из них окисляется при достаточном содержании кислорода в воздухе и от высокой температуры, и не представляют опасность.
Продукты, образующиеся при полном горении, неспособны в дальнейшем поддерживать термический процесс. К этой группе, например, относится углекислый газ. Его токсичность зависит от концентрации в воздухе — при содержании более 8–10% у человека наступает отравление.
При неполном окислении, в условиях недостаточного притока воздуха и низкой температуры, образуются токсичные продукты горения. Они способны поддерживать пламя, а в определённых концентрациях с воздухом образовывать взрывоопасные смеси. Примером из этой группы является угарный газ.
Дым представляет собой взвесь мельчайших твёрдых частиц. При пожарах он наравне с огнём опасен для человека.

