Диметиламин — dimethylamine
Содержание:
- Классификация аминов
- Химия
- Возникновение и реакции [ править ]
- Токсикологические свойства и характеристики
- диметиламин: основная информация о пестициде
- Получение аминов
- Изомерия и структурные формулы аминов
- Инструкции по технике безопасности
- Способы получения
- Применение
- Действие на вредные организмы
- Приминение
- История появления вещества Диметилтриптамин
- Диметиламин
- Ссылки [ править ]
- Действие на вредные организмы
- диметиламин: поведение в окружающей среде
- Индивидуальные доказательства
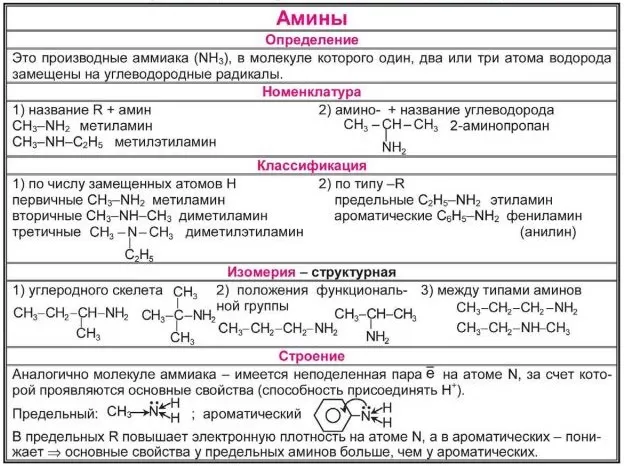
Классификация аминов
Амины можно классифицировать по природе и количеству заместителей у азота. Алифатические амины содержат только Н и алкильные заместители. Ароматические амины имеют атом азота, связанный с ароматическим кольцом.
Амины, как алкил, так и арил, разделены на три подкатегории зависимости от количества атомов углерода, примыкающих к азоту (сколько атомов водорода в молекуле аммиака заменено углеводородными группами):
- Первичные (1 °) амины — Первичные амины возникают, когда один из трех атомов водорода в аммиаке заменяется алкильной или ароматической группой. Важные первичные алкиламины включают метиламин , большинство аминокислот и буферный агент трис , тогда как первичные ароматические амины включают анилин .
- Вторичные (2 °) амины. Вторичные амины имеют два органических заместителя (алкил, арил или оба), связанных с азотом вместе с одним водородом. Важные представители включают диметиламин , в то время как примером ароматического амина может быть дифениламин .
- Третичные (3 °) амины. В третичных аминах азот имеет три органических заместителя. Примеры включают триметиламин , который имеет отчетливо рыбный запах, и ЭДТА .
Четвертая подкатегория определяется связностью заместителей, присоединенных к азоту:
Циклические амины — Циклические амины являются вторичными или третичными аминами. Примеры циклических аминов включают азиридин с 3-членным кольцом и пиперидин с шестичленным кольцом . N- метилпиперидин и N- фенилпиперидин являются примерами циклических третичных аминов.
Также возможно наличие четырех органических заместителей у азота. Эти частицы не являются аминами, а представляют собой катионы четвертичного аммония и имеют заряженный азотный центр. Соли четвертичного аммония существуют со многими видами анионов.
Химия
Ядро C 2 N 2 O NDMA является плоским, как установлено с помощью рентгеновской кристаллографии . Центральный азот связан с двумя метильными группами и группой NO с валентными углами 120 °. Расстояния NN и NO равны 1,32 и 1,26 Å соответственно.
NDMA образуется из множества диметиламинсодержащих соединений, например, при гидролизе диметилформамида . Диметиламин подвержен окислению до несимметричного диметилгидразина , который окисляется на воздухе до NDMA.
В лаборатории NDMA можно синтезировать реакцией азотистой кислоты с диметиламином :
- HONO + (CH 3 ) 2 NH → (CH 3 ) 2 NNO + H 2 O
Механизм его канцерогенности включает стадии метаболической активации, приводящие к образованию метилдиазония, алкилирующего агента .
Метаболическая активация NDMA, связанная с его причиной рака.
Возникновение и реакции [ править ]
Это аттрактант для долгоносиков .
Диметиламин подвергается нитрозированию с образованием канцерогена диметилнитрозамина .
Депротонирование диметиламина может осуществляться с помощью литийорганических соединений. Получающийся в результате LiNMe 2 , который принимает кластерную структуру, служит источником «Me 2 N —Этот амид лития был использован для получения комплексов летучих металлов, таких как тетракис (диметиламидо) титан и пентакис (диметиламидо) тантал .
В основании Льюиса свойство диметиламина рассматривается в модели ECW . Его относительная донорская сила по отношению к ряду кислот по сравнению с другими основаниями Льюиса может быть проиллюстрирована графиками CB .
Токсикологические свойства и характеристики
В почве. Передвигаясь вверх и вниз вслед за передвижением почвенной влаги, разрушается под влиянием микроорганизмов, довольно медленно, за несколько недель. Поглощается лучше почвами, которые богаты органическим веществом.
В растениях. Согласно литературным источникам, в защищаемых злаковых растениях быстро разрушается, вследствие чего не обнаруживается в зерне ко времени уборки.
В злаках, устойчивых к гербициду, дикамба (диметиламинная соль) распределяется по всему растению равномерно и быстро подвергается разрушению. В окружающую среду может выделяться значительная ее часть.
Не допускаются остаточные количества в просе, кукурузе и зерне хлебных злаков.
Полезные виды и энтомофаги. Гербицид практически не опасен для пчел. Тем не менее, при обработках необходимо строго придерживаться регламента: скорость ветра должна быть не выше 5-6 м/с, соблюдение погранично-защитной зоны для пчел – более 1-2 км, ограничение лета пчел – от 6 до 12 часов.
Теплокровные. Препарат малотоксичен для теплокровных.
Симтомы отравления. Клиническая картина острого отравления: снижение активности, нарушение координации, судороги, недержание мочи.
Классы опасности. Препараты на основе солей дикамбы относятся к третьему классу опасности для человека и третьему и четвертому классам опасности для пчел.
диметиламин: основная информация о пестициде
Описание: Продукт преобразования пестицида
Год официальной регистрации: Не определяется
Выпуск пестицидов на рынок (директива 91/414/ЕЭС), статус:
| Статус | Не определяется |
| Досье докладчика / содокладчика | Не определяется |
| Дата включения истекает | Не определяется |
Разрешен к применению (V) или известен (#) в следующих Европейских странах:
Основные сведения:
| Тип пестицида | Метаболит |
| Тип метаболита | почва |
| Группа по химическому строению | Амин |
| Характер действия | Не применимый |
| Регистрационный номер CAS | 124-40-3 |
| Шифр КФ (Код Фермента) | 204-697-4 |
| Шифр Международного совместного аналитического совета по пестицидам (CIPAC) | — |
| Химический код Агентства по охране окружающей среды США (US EPA) | Не определяется |
| Химическая формула | C2H7N |
| SMILES | N(C)C |
| Международный химический идентификатор (InChI) | InChI=1/C2H7N/c1-3-2/h3H,1-2H3 |
| Структурная формула | 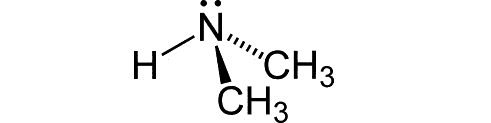 |
| Молекулярная масса (г/моль) | 45.08 |
| Название по ИЮПАК | dimethylamine |
| Название по CAS | dimethylamine |
| Другая информация | — |
| Устойчивость к гербициду по HRAC | Не определяется |
| Устойчивость к инсектициду по IRAC | Не определяется |
| Устойчивость к фунгициду по FRAC | Не определяется |
| Физическое состояние | Газ |
Может быть продуктом:
| Исходное вещество | Среда образования | Расчетный максимум рапространения фракции | Соответствие директиве 91/414 |
Выпуск:
| Производители пестицида | |
| Коммерческие названия препаратов, содержащих д.в. | — |
| С этим веществом связаны: | — |
| Оценка риска от пестицида для местной экологии (Англия) | Не определяется |
| Препаративная форма и особенности применения | — |
Получение аминов
Промышленное получение этих азотсодержащих соединений началось с получения анилина русским химиком-органиком Н. Н. Зининым в 1842 году. Реакция, названная именем известного химика, предусматривает восстановление нитробензола сульфидом аммония по следующему химическому уравнению:
Промышленная схема производства анилина выглядит следующим образом:
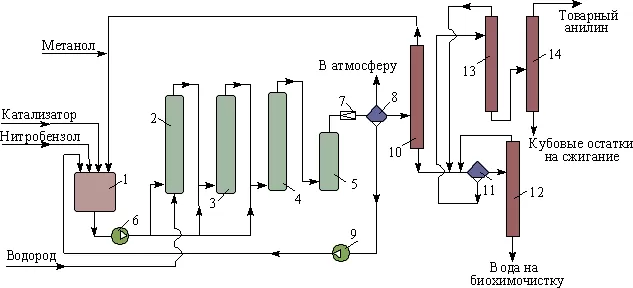
Другие способы получения, используемые на производстве и в лабораторных условия, включают в себя:
-
восстановление амидов алюмогидридом лития;
-
восстановительную реакцию для получения первичных аминов, где в качестве исходного вещества предусматривается нитрил;
-
различные виды реакции алкилирования, при которой в молекулы аммиака или низшего амина вводится алкильная группа.
Изомерия и структурные формулы аминов
Для производных аммиака с замещенными атомами водорода характерны два основных типа изомерии:
-
структурная изомерия;
-
оптическая изомерия.
Каждый тип структурных изомеров характеризуется низшим амином, начиная с которого он доступен.
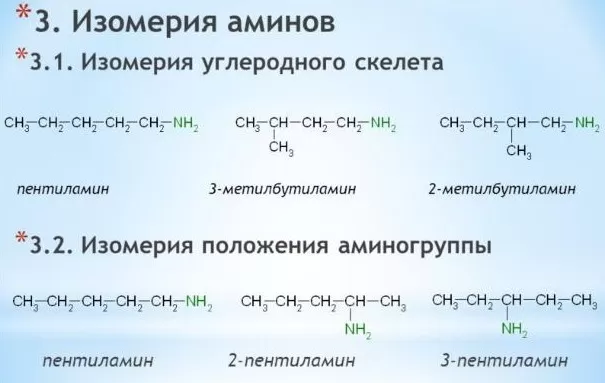
Можно выделить три основных признака структурных изомеров:
-
изомерия углеродного скелета, при которой количество замещенных атомов водорода остается неизменным, но меняется структура углеводородного радикала;
-
положение аминогруппы в углеводной цепочке наблюдаемое, начиная с пропанамина и изопропанамина;
-
изомерия аминогруппы, при которой отличается количество атомов водорода, замещенных углеводородными цепочками.
Строение углеродного скелета изомеров на примере бутанамина:
СН₃-СН₂-СН₂-СН₂-NH₂
бутиламин (бутанамин-1);
вторбутиламин (бутанамин-2);
изобутиламин (2-метилпропанамин-1);
третбутиламин (2-метилпропанамин-2).
Изменение положения аминогруппы в углеводородной цепочке также приводит к появлению изомеров.
Инструкции по технике безопасности
Диметиламин — чрезвычайно легковоспламеняющийся газ, который образует с воздухом взрывоопасные смеси. При высоких концентрациях также существует риск удушья . Диметиламин всасывается в основном через дыхательные пути и кожу . Это приводит к острому раздражающему или едкому воздействию на слизистые оболочки , глаза , дыхательные пути и кожу. Кроме того, был обнаружен слабый механизм действия центральной нервной системы . У пострадавшего возникают хронические нарушения в центральной нервной системе и общее недомогание. Для репродуктивной токсичности не известно нет достаточной информации. Было обнаружено, что сам по себе диметиламин не обладает мутагенными или канцерогенными свойствами , только высокотоксичные вторичные соединения, такие как нитрозамины, демонстрируют повышенный канцерогенный и генно-изменяющий потенциал. Диметиламин имеет нижний предел взрываемости около 2,80 об.% При 52 г / см 3 и верхний предел взрываемости около 14,4 об.% При 270 г / см 3 . Температура возгорания около 400 ° C. Таким образом, вещество относится к температурному классу T2 и группе взрывоопасности IIA. Ограничения зазора ширина была определена в 1,15 мм. С температурой вспышки -55 ° C диметиламин чрезвычайно огнеопасен.
Способы получения
Изготовление монометиламина в производственных масштабах возможно при наличии аммиака и метанола. Нужная реакция перечисленных веществ происходит только при высокой температуре — начиная от +370 и оканчивая +430 °С. Показатели давления при этом должны варьироваться в пределах 20–30 бар. Наличие контактного цеолитного катализатора — обязательное условие. Реакция, в результате которой образуется метиламин, осуществляется в газофазе. Вместе с ним формируются:
- вода;
- диметиламин;
- триметиламин.
В целях получения чистого соединения прибегают к неоднократной перегонке. Описанный производственный процесс считают основным. Однако существуют и другие способы синтеза. Для получения соединения также используют формалин и хлорид аммония. Вещества вступают в реакцию после нагрева. В лабораторных условиях метиламин получают согласно технологии перегруппировки по Гофману.
Применение
Участки, идущие в будущем году под посев яровой зерновой культуры, обрабатываются гербицидом в послеуборочный период по растущим сорнякам с целью уничтожения многолетних двудольных сорных растений. Препарат также используют в борьбе с ядовитыми и вредными растениями на пастбищах и сенокосах. Меньшие нормы расхода препарата используют при обработке полевых культур, высокие – лесопитомников, паровых полей, а также лиственно-хвойных и лиственных древостоев.
Препарат применяется на ржи, ячмене, пшенице, овсе в фазе кущения, в посевах гречихи за 2 или 3 дня до появления всходов, в посевах сорго, проса, на кукурузе в фазе 3-х-5-ти листьев, в посевах злаковых (райграса, тимофеевки луговой и др.). Также он рекомендован для обработки посевов эфиромасличных культур (мяты, лаванды, кориандра и др.).
Зарегистрированные препараты на основе:
- 2,4-Д (диметиламинная соль) используются против двудольныходнолетних сорняков на посевах овса, клещевины, пшеницы озимой и яровой, кориандра, ячменя, ржи, кукурузы, тимофеевки луговой, ежи сборной, гречихи, клевера ползучего и др.;
- 2,4-Д (диметиламинная соль) и хлорсульфурона (диэтилэтаноламинная соль) – против однолетних двудольныхсорняков, в т.ч. устойчивых к и 2М-4Х, и некоторых многолетних двудольных сорняков на посевахпшеницы озимой и яровой, овса, ячменя ярового.
Действие на вредные организмы
Диметиламинная соль кислоты (2,4-ДМА) является наиболее распространенным гербицидом для уничтожения однолетних двудольных сорняков в посевах зерновых. После опрыскивания время ожидания 45 дней.
2,4-ДМА, так же, как и , дикамба, 2М-4Х, является системным гербицидом с росторегулирующим действием. В оптимальных концентрациях они очень избирательны, подавляют двудольные и никак не действуют на злаки.
Механизм действия. Диметиламинная соль 2,4-дихлорфеноксиуксусной кислоты (2,4-ДМА), как и другие арилоксиалканкарбоновые кислоты и их производные, нарушают развитие и рост клеток ксилемы и флоэмы, вызывая изменение формы листьев и стеблей, образование воздушных корней. Также они могут задерживать образование хлорофилла и пластид, что в конечном итоге приводит к угнетению фотосинтеза.
Подавляемые сорные виды. 2,4-Д ДМА уничтожает многие двудольные однолетние сорные растения: василек синий, бодяк полевой, амброзия полыннолистная, вика четырехсемянная, дурнушник обыкновенный, живокость полевая, дымянка лекарственная, лапчатка прямостоячая, клубнекамыш приморский, льнянка обыкновенная, мак, лютик ползучий, осот полевой, марь белая, одуванчик обыкновенный, горчица полевая, паслен черный, подсолнечник сорный однолетний, сурепица обыкновенная, пастушья сумка, редька дикая, якорцы наземные, ширица колосистая, ярутка полевая и некоторые другие. Подавляет также многолетние двудольные сорные растения: молокан татарский, осоты, подорожники, вьюнок полевой.
Приминение
Дикамбу (диметиламинная соль) применяют для подавления сорняков, имеющих устойчивость к гербицидам на основе 2,4-Д и МЦПА. Гербицид может быть использован и как самостоятельный препарат, и в баковых смесях с другими соединениями. Обладает синергизмом с производными МЦПА, , глифосата, сульфонилмочевины. Это экономически выгодный и наиболее распространенный компонент нескольких комбинированных препаратов. Дикамба, из всех препаратов, имеющих ауксиновый механизм действия, более токсична (менее избирательна) по отношению к зерновым культурам при отклонении от рекомендованной фазы применения (кущение до выхода в трубку).
Гербицид рекомендован для опрыскивания посевов овса, проса, ячменя, пшеницы в фазе кущения культуры, двух-четырех листьев у 1-летних и 15 см высоты у многолетних сорных растений. Кукурузу опрыскивают в фазе трех-пяти листьев и при 15 см высоты у многолетних сорняков.
Зарегистрированные препараты на основе:
- дикамбы (диметиламинная соль) разрешены к использованию против однолетних двудольных, в т.ч. устойчивых к производным арилоксиалканкарбоновой кислоты, и некоторых многолетних двудольных сорняков в посевах овса, ржи, озимой и яровой пшеницы, ячменя, проса; против однолетних 2-дольных, в т.ч. устойчивых к и триазинам, и некоторых многолетних двудольных, включая виды осота (бодяк и др.), сорняков на посадках кукурузы; против щавеля, лютиков, чемерицы, борщевика и др. на сенокосах; против однолетних двудольных и некоторых многолетних двудольных (за исключением горчака ползучего) сорняков на землях несельскохозяйственного пользования, парах;
- дикамбы (диметиламинная соль) и римсульфурона против однолетних и многолетних двудольных и злаковых (в т.ч. однолетних двудольных, проявляющих устойчивость к 2М-4Х и ) сорняков в посадках кукурузы;
- дикамбы (диметиламинные соли) и рекомендуются к применению для контроля однолетних и некоторых многолетних двудольных сорняков на посевахсельскохозяйственных культур; видов осота на посевах кукурузы;
- дикамбы (диметиламинная соль) и топрамезона против однолетних и некоторых многолетних двудольных, в т.ч. имеющих устойчивость к , и некоторых однолетних злаковых сорняков в посадках кукурузы.
Баковые смеси. Соединение используется для приготовления комбинированных гербицидов путем смешивания с МЦПА и , а также с препаратами на основе глифосфата кислоты (изопропиламинная соль), метсульфурон-метила и пр. Перед использованием необходимо проверить вещества на совместимость, фитотоксичность и стабильность.
История появления вещества Диметилтриптамин
Впервые диметилтриптамин был синтезирован в 1931 году английским химиком Ричардом Мански. Но веществу не было найдено применение, поэтому его изучение приостановилось.
В 1946 году бразильский химик Гонсалвес де Лима синтезировал ДМТ из корня мимозы. Ученый дал название веществу «Нигерин».
Психотропные свойства вещества были открыты в середине 50-х годов прошлого века венгерским доктором
С целью изучения психоактивных веществ, он обратил внимание на ДМТ, которое по своим свойствам оказалось схожим с ЛСД. С этого времени началось активное распространение вещества, формирование зависимости у людей
Диметиламин
Диметиламин, ( CHS) 2NH ( водный раствор) — бесцветная или слабо окрашенная в желтый цвет жидкость. Получают из диметиланили-на или из метилового спирта.
Диметиламин при взаимодействии с сероуглеродом и солями меди образует диметилдитиокарбамат меди, окрашивающий раствор в желто-зеленый цвет. Содержание диметиламина определяют колориметрически по стандартной шкале.
Диметиламин ( СНзЬМН — бесцветная или слабо окрашенная в желтый цвет жидкость со специфическим запахом.
Диметиламин реагирует с гидридом алюминия в эфирном растворе при комнатной температуре.
Диметиламин ( CH3) 2NH выделяется при гниении белков ( особенно рыбы), содержится в селедочном рассоле, газообразен, сгущается в жидкость при 7 4 С.
Диметиламин при десорбции насыщенного растворителя отгоняется вместе с изоамиленами или изопреном, оказывая в дальнейшем вредное действие на дегидрирование изоами-ленов и стереоспецифическую полимеризацию изопрена. Муравьиная кислота, смешанная с растворителем, вызывает коррозию аппаратуры и, реагируя с железом, образует фор-миат железа, который при охлаждении выпадает в осадок, забивающий кипятильники.
Диметиламин — полярографически неактивное вещество.
Диметиламин действует раздражающе на слизистые носа, глаз и верхних дыхательных путей.
Диметиламин готовится из хлористоводородной соли следующим образом: в длинную — ( около 60 см.) трубку, запаянную с одного конца, помещается до половины трубки смесь соли и негашеной извести в порошке в требуемых уравнением реакции отношениях, остальное пространство засыпается известью в кусках. Трубка нагревается на печке для органического анализа, а выделяющийся свободный сухой диметиламин собирается в трубочках, помещенных в смесь снега и соли; трубочки потом запаиваются.
Диметиламин и триметиламин обнаружены в селедочном рассоле. Ди мети л амин можно легко получить из нитрозодиметиланилина ( стр.
Диметиламин охлаждают в конической колбочке на 30 мл до 5 и смешивают с холодной уксусной кислотой и формалином. Холодную смесь выливают во вторую колбочку, содержащую 2 4 г индола, колбочку из-под смеси ополаскивают 1 мл воды и эту воду присоединяют ко всей реакционной массе. При перемешивании индол постепенно растворяется, а смесь нагревается до комнатной температуры. Полученную однородную смесь затем приливают при энергичном перемешивании к раствору, содержащему 4 г едкого натра в 30 мл воды, сюда же присоединяют воду, использованную для ополаскивания. Выпадает объемистый белый осадок, который после стояния в течение 2 ч в охладительной бане отсасывают на фарфоровой воронке или воронке с пористым стеклянным дном, трижды промывают холодной водой и сушат на воздухе.
Диметиламин весьма реакционноспособен, и реакции с его участием обычно дают прекрасные выходы. Диэтил-амин, невидимому, менее реакционноспособен, так как имеется указание , что этилметилкетон ие вступает в реакцию Манниха с диэтиламином и формальдегидом. С другой стороны, при конденсации формальдегида и диэтилами-на с ацетоном , ац гофеаоном образуются нормальные продукты реакции.
Диметиламин ( CH3) 2NH выделяется при гниении белков ( особенно рыбы), содержится в селедочном рассоле, газообразен, сгущается в жидкость при 7 4 С.
Диметиламин, освобождающийся при щелочном гидролизе, отгоняют с паром в стандартную кислоту и определяют титрованием.
Диметиламин, взаимодействуя с нитрильными группами полиакрилонитрила, образует глубоко окрашенные соединения, вследствие чего прядильный раствор и сформованные из него волокна приобретают желтую или бурую окраску. Для предохранения растворов полиакрилонитрила в диметилформамиде от окрашивания часто рекомендуют добавлять небольшое количество веществ кислого характера, связывающих диметиламин, например щавелевую или серную кислоту.
Ссылки [ править ]
- ^ «Диметиламин» . Интернет-книга NIST по химии . США: Национальный институт стандартов и технологий . Проверено 21 октября 2011 года .
- ^ «Диметиламин 38931 — ≥99,0%» . Олдрич . Sigma-Aldrich Co . Проверено 21 октября 2011 года .
- ^ a b c Карманный справочник NIOSH по химической опасности. «# 0219» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ a b «Диметиламин» . Немедленно опасная для жизни или здоровья концентрация (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б Ван Гизель, Август Б.; Мусин, Вилли (2000). «Метиламины». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI10.1002 / 14356007.a16_535 .
- ^ Корбин DR; Schwarz S .; Sonnichsen GC (1997). «Синтез метиламинов: обзор». Катализ сегодня . 37 (2): 71–102. DOI10.1016 / S0920-5861 (97) 00003-5 .
- ^ Нейрат, Великобритания; и другие. (1977). «Первичные и вторичные амины в среде человека». Пищевая и косметическая токсикология . 15 (4): 275–282. DOI10.1016 / s0015-6264 (77) 80197-1 .
- ^ Словарь промышленных химикатов Эшфорда , 3-е издание, 2011 г., страницы 3284-3286
- ^ Индекс Мерк, 10-е изд. (1983), стр. 470, Rahway: Merck & Co.
- Перейти ↑ Laurence, C. and Gal, JF. Шкалы основности и сродства Льюиса, данные и измерения, (Wiley 2010), стр. 50-51, IBSN 978-0-470-74957-9
- ^ Крамер, RE; Бопп, Т. Т. (1977). «Графическое отображение энтальпий образования аддуктов для кислот и оснований Льюиса». Журнал химического образования . 54 : 612–613. DOI10.1021 / ed054p612 .На графиках, представленных в этом документе, использовались более старые параметры. Улучшенные параметры E&C перечислены в модели ECW .
- ^ Профиль химической информации для диметиламинборана, Национальная программа токсикологии, NIEHS, NIH (2008), стр. 4: http://ntp.niehs.nih.gov/ntp/htdocs/Chem_Background/ExSumPdf/DimethylamineBorane508.pdf
Действие на вредные организмы
Гербицид, накапливаясь в молодых листьях чувствительных сорных растений, разрушается медленно, хорошо проявляя свое фитотоксическое действие.
Период защитного действия после одной обработки при соблюдении регламента применения составляет 1-1,5 месяца.
Механизм действия. Препарат хорошо передвигается в почве и растениях. В растение проникает через листья и корни, двигается по флоэме и ксилеме. Накопление вещества в молодых листьях происходит у чувствительных растений, в устойчивых оно распределяется по всему растению, затем разрушается.
Дикамба может быть отнесена к группе гербицидов с ауксиноподобной активностью. Ее действие проявляется в увеличении скорости синтеза РНК и ее концентрации, ускорении синтеза липидов и белка, увеличении растяжимости оболочек и росте клеток в длину.
Гербицид начинает проявлять свое действие через два-три часа, если условия для этого благоприятны: температура 18-24°С и нет осадков. Сорняки погибают через две-четыре недели.
Подавляемые сорные виды. Гербицид в относительно небольших дозах подавляет многие двудольные сорняки,имеющиеустойчивость к 2,4-Д и МЦПА (горчица полевая, мокрица-звездчатка, подмаренник цепкий, крестовник обыкновенный, горцы вьюнковый и развесистый и др.), и некоторые многолетние в более высоких дозах (бодяк, амброзия, горчак, вьюнок, осоты). Также препарат используют в борьбе с чемерицей, борщевиком, лютиком для улучшения пастбищ и лугов и для освобождения земель несельскохозяйственного пользования от растительности.
Резистентность. Резистентности не наблюдается при соблюдении условий применения препарата. Однако злаковые сорняки, находящиеся в фазе кущения, устойчивы к препарату.
диметиламин: поведение в окружающей среде
| Показатель | Значение | Источник / Качественные показатели / Другая информация | Пояснение | |
| Растворимость в воде при 20oC (мг/л) | 1630000 | V3 — @ 25 DegC | Высокий | |
| Растворимость в органических растворителях при 20oC (мг/л) | — | — | — | |
| Температура плавления (oC) | -92.2 | V3 | — | |
| Температура кипения (oC) | — | — | — | |
| Температура разложения (oC) | — | — | — | |
| Температура вспышки (oC) | — | — | — | |
| Коэффициент распределения в системе октанол/вода при pH 7, 20oC | P: | 4.17 X 10-01 | Рассчитывается | — |
| Log P: | -0.38 | V3 | Низкий | |
| Удельная плотность (г/мл) / Удельный вес | 0.68 | V3 | — | |
| Константа диссоциации (pKa) при 25oC | 10.73 | V3 | — | |
| Примечание: Очень слабая кислота | ||||
| Давление паров при 25oC (МПа) | — | — | — | |
| Константа закона Генри при 25oC (Па*м3/моль) | 9.00 X 10-05 | L3 | Не летуч | |
| Константа закона Генри при 20oC (безразмерная) | 3.37 X 10-09 | Q2 | Не летуч | |
| Период распада в почве (дни) | ДТ50 (типичный) | — | — | — |
| ДТ50 (лабораторный при 20oC): | — | — | — | |
| ДТ50 (полевой): | — | — | — | |
| ДТ90 (лабораторный при 20oC): | — | — | — | |
| ДТ90 (полевой): | — | — | — | |
| Примечание: | — | |||
| Водный фотолиз ДТ50 (дни) при pH 7 | Значение: | — | — | — |
| Примечание: | — | |||
| Водный гидролиз ДТ50 (дни) при 20oC и pH 7 | Значение: | — | — | — |
| Примечание: | — | |||
| Водное осаждение ДТ50 (дни) | — | — | — | |
| Только водная фаза ДТ50 (дни) | — | — | — | |
| Индекс потенциального вымывания GUS | — | — | — | |
| Индекс роста концентрации в грунтовых водах SCI (мкг/л) при дозе внесения 1 кг/га (л/га) | Значение: | — | — | — |
| Примечание: | — | |||
| Potential for particle bound transport index | — | — | — | |
| Koc — коэффициент распределения органического углерода (мл/г) | — | — | — | |
| pH устойчивость: | ||||
| Примечание: | ||||
| Изотерма адсорбции Фрейндлиха | Kf: | — | — | — |
| 1/n: | — | — | ||
| Примечание: | — | |||
| Максимальное УФ-поглощение (л/(моль*см)) | — | — | — |
Индивидуальные доказательства
- ↑ вход на в базе данных GESTIS вещества в IFA , доступ к 8 января 2021 года. (Требуется JavaScript)
- Дэвид Р. Лид (Ред.): Справочник CRC по химии и физике . 71-е издание. (Интернет-версия :), CRC Press / Тейлор и Фрэнсис, Бока-Ратон, Флорида, Константы диссоциации органических оснований в водных растворах, стр. 8-33.
- ↑ Запись о В: Römpp Online . Георг Тиме Верлаг, доступ 2 февраля 2019 г.
- Дэвид Р. Лид (Ред.): Справочник CRC по химии и физике . 90-е издание. (Интернет-версия: 2010 г.), CRC Press / Тейлор и Фрэнсис, Бока-Ратон, Флорида, Стандартные термодинамические свойства химических веществ, стр. 5-20.
- ↑
- ↑ Ханс-Юрген Арпе: Промышленная органическая химия — важные предварительные и промежуточные продукты . 6-е издание. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6 , стр.55 .
- Дж. Г. Астон, К. В. Стиллер, Г. Х. Мессерли: Теплоемкости и энтропии органических соединений. III. Метиламин от 12К до точки кипения. Теплота испарения и давление пара. Энтропия из молекулярных данных . В: Журнал Американского химического общества . Лента59 , нет.9 , 1937, стр.1743-1751 , DOI : ( на английском языке).
