Способы снижения выбросов оксидов азота в окружающую среды
Содержание:
- Литература
- Физические свойства оксида азота (IV):
- Характеристики
- Синтез жизни
- Метрологическое подтверждение оксидов азота
- Опасность двуокиси азота для организма человека
- «Био/мол/текст»-2016
- Последствия заражения сернистым газом и азотом
- Основные понятия
- Выхлопные газы в атмосфере городов
- ГН ПДК в атмосферном воздухе населенных мест 2018
- Физико-химическая характеристика
- Свойства и характеристики вещества
- Как измеряют концентрацию вредных веществ
- Влияние озона на здоровье человека
- Методики исследований
- Как уменьшить количество диоксида азота в салоне авто
- Выводы
Литература
- The Haber Process. Сайт chemguide;
- Механизм биологической фиксации молекулярного азота. Сайт «Академик»;
- Брей С.М. Азотный обмен в растениях. М.: Агропромиздат, 1986. — 199 с.;
- Mylona P., Pawlowski K., Bisseling T. (1995). Symbiotic nitrogen fixation. Plant Cell. 7, 869–885;
- Lacey J.M. and Wilmore D.W. (1990). Is glutamine a conditionally essential amino acid? Nutr. Rev. 48, 297–309;
- Barnes M.R. and Gray I.C. Bioinformatics for geneticists. Wiley, 2003. — 350 p.;
- Википедия: «Нитрификация» (en.);
- Kuenen J.G. (2008). Anammox bacteria: from discovery to application. Nat. Rev. Microbiol. 6, 320–326;
- Devol A.H. (2003). Nitrogen cycle: solution to a marine mystery. Nature. 422, 575–576;
- Hongoh Y., Sharma V.K., Prakash T., Noda S., Toh H., Taylor T.D. et al. (2008). Genome of an endosymbiont coupling N2 fixation to cellulolysis within protist cells in termite gut. Science. 322, 1108–1109.
Физические свойства оксида азота (IV):
| Наименование параметра: | Значение: |
| Химическая формула | NO2 |
| Синонимы и названия иностранном языке | nitrogen dioxide (англ.) nitrogen(IV) oxide (англ.)
азота двуокись (рус.) азота диоксид (рус.) диазота тетраоксид (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | красно-бурый газ или желтоватая жидкость |
| Цвет | красно-бурый, желтоватый |
| Вкус | —* |
| Запах | характерный острый запах |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность (состояние вещества – жидкость, при 0 °C), кг/м3 | 1491 |
| Плотность (состояние вещества – жидкость, при 0 °C), г/см3 | 1,491 |
| Плотность (состояние вещества – газ), кг/м3 | 2,0527 |
| Плотность (состояние вещества – газ), г/л | 2,0527 |
| Температура кипения, °C | 21,1 |
| Температура плавления, °C | -11,2 |
| Молярная масса, г/моль | 46,0055 |
Примечание: * — нет данных.
Характеристики
Диоксид азота представляет собой красновато-коричневый газ при температуре выше 21,2 ° C (70,2 ° F; 294,3 K) с резким, едким запахом, становится желтовато-коричневой жидкостью при температуре ниже 21,2 ° C (70,2 ° F; 294,3 K) и превращается в бесцветный четырехокись азота ( N2О4) ниже -11,2 ° C (11,8 ° F, 261,9 K).
Длина связи между атомом азота и атомом кислорода составляет 119,7 пм . Эта длина связи соответствует порядку связи от одного до двух.
В отличие от озона , O 3 , основное электронное состояние диоксида азота представляет собой дублетное состояние , поскольку азот имеет один неспаренный электрон, что снижает альфа-эффект по сравнению с нитритом и создает слабое связывающее взаимодействие с неподеленными парами кислорода. Одинокий электрон в NO2также означает, что это соединение является свободным радикалом , поэтому формула диоксида азота часто записывается как • NO2.
Красновато-коричневый цвет является следствием преимущественного поглощения света в синей области спектра (400-500 нм), хотя поглощение распространяется во всем видимом (на более коротких длинах волн) и в инфракрасном диапазоне (на более длинных волнах). Поглощение света на длинах волн короче примерно 400 нм приводит к фотолизу (с образованием NO + O, атомарного кислорода); в атмосфере добавление образовавшегося таким образом атома O к O 2 приводит к образованию озона.
Синтез жизни
Хорошо, растение добыло себе аммиак, а что дальше? Дальше он включается в реакции синтеза аминокислот. Так из аспарагиновой кислоты синтезируется аспарагин, из глутамата — глутамин (рис. 4). В виде глутамина азот доставляется ко всем клеткам организма, где используется для синтеза азотсодержащих органических соединений .

Рисунок 4. Глутамин. а — Реакция превращения глутамата в глутамин. б — Функции глутамина.
Аспарагин также синтезируется с участием аммиака (рис. 5) .
Рисунок 5
Реакции, проходящие у живых организмов для синтеза аспарагина — важного нейромедиатора. Оксалоацетат — название щавелевоуксусной кислоты (ЩУК)
Тут она служит каркасом будущей аминокислоты. С глутамата «снимается» азот, в результате чего глутамат превращается в альфа-кетоглутарат, а аммиак переносится на ЩУК. Образуется аспартат, на который далее переносится H2N, и с затратой АТФ аспартат превращается в аспарагин.
«Википедия», рисунок адаптирован
Аспарагин — это очень распространенная заменимая аминокислота, которая включена в состав почти всех белков живых организмов. Глутамин также является «популярной» аминокислотой: в организмах животных с помощью него аммиак выводится из организма или используется повторно.
Метрологическое подтверждение оксидов азота
Измерение выбросов
Методы хемилюминесценции можно использовать для измерения оксидов азота в выхлопных газах от стационарных источников . Для этого используется свойство монооксида азота излучать свет, когда он превращается в диоксид азота (хемилюминесценция). Типичный частичный поток отбирается из выхлопного газа и после прохождения через конвертер, который превращает любой диоксид азота, который может присутствовать в монооксид азота, приводится в контакт с озоном . Свет, излучаемый во время реакции, преобразуется фотоумножителем в электрический сигнал, который предоставляет информацию о концентрации оксида азота.
Для определения оксида азота и диоксида азота с помощью ионной хроматографии эти газы преобразуются в азотную кислоту с помощью озона или перекиси водорода и воды. Затем анализируется концентрация нитратов.
Другими методами измерения оксидов азота в выхлопных газах из стационарных источников являются метод салицилата натрия и метод диметилфенола. В процессе салицилата натрия оксид азота и диоксид азота окисляются до азотной кислоты, а затем превращаются в нитросалициловую кислоту с помощью салицилата натрия . Концентрация желтого аниона нитросалициловой кислоты, который образуется после следующей стадии обработки, может быть определена фотометрически и, таким образом, предоставлена информация о концентрации оксида азота в отобранном газе. Для диметилфенольного процесса монооксид азота и диоксид азота окисляются до пятиокиси азота с помощью озона в газовой фазе, который после абсорбции водой превращается с 2,6-диметилфенолом в растворах серной и фосфорной кислоты в 4-нитро-2, 6-диметилфенол , анион которого также может быть измерен фотометрически.
Одним из методов определения закиси азота в выхлопных газах от стационарных источников является недисперсионный инфракрасный метод . Для этого газ в измерительной газовой ячейке и эталонной ячейке освещается инфракрасным излучателем. Оба луча обнаруживаются приемником и сравниваются друг с другом. Ослабленный луч по сравнению с эталонной ячейкой является мерой концентрации закиси азота. Чтобы свести к минимуму перекрестную чувствительность процесса из-за мешающего монооксида углерода , он превращается в диоксид углерода с помощью преобразователя из оксидов металлов .
Важно, чтобы все компоненты измерительного устройства, которые вступают в контакт с отбираемым газом, не вступали в реакцию с оксидами азота
Измерение иммиссии
Измерение на оживленной дороге как индикатор качества воздуха
Зольцман метод может быть использован для измерения в иммиссия диоксида азота , в котором образец воздух пропускают через реакционный раствор , который вступает в реакцию с компонентом газа , чтобы быть обнаруженным , чтобы сформировать красный азокраситель . Интенсивность окраски реакционного раствора определяется фотометрически и является мерой массы диоксида азота. Используя окислитель, можно также использовать метод Зальцмана для определения оксида азота.
Как и в случае измерения эмиссии , хемилюминесцентные методы также могут использоваться для измерения иммиссии.
Другой возможностью для измерения содержания диоксида азота является использование пассивных коллекторов . Проволочная сетка, изготовленная из триэтаноламина, на которую нанесен диоксид азота, расположена в стеклянной трубке, открытой снизу . По окончании периода сбора проволочная сетка обрабатывается комбинированным реагентом для фотометрического анализа результирующего изменения цвета.
Опасность двуокиси азота для организма человека
Оказываясь в организме, диоксид азота нарушает работу органов дыхания путем агрессивного воздействия на слизистые оболочки, вызывая при продолжительном контакте бронхит и эмфизему. Токсичное вещество может принадлежать к одной из трех категорий, в зависимости от содержания в рабочей зоне: малоопасной, умеренной и чрезвычайно опасной.
Опасность отравления диоксидом азота состоит в том, что на первых этапах оно практически незаметно и проходит бессимптомно. Симптомы проявляются только в случае попадания значительного объема газа в организм. Первыми признаками отравления считаются головная боль, общая слабость, боли в области груди, кашель и спазмы. При усугублении интоксикации растет температура тела, усиливается тошнота, появляется кашель с мокротой, а также нарушается работа легких и других органов дыхания.
К группе особого риска отравления двуокисью азота относятся жители крупных городов индустриального типа, так как именно в них концентрация токсичного вещества чаще всего превышает допустимые нормы. Для определения уровня содержания диоксида азота необходим химический анализ атмосферного воздуха, который позволяет выявить степень заражения веществом.

Это интересно: Погибший при пожаре
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила .
Что вообще такое азот? На Земле азот представлен своим двухатомным соединением в виде газа (N2) и составляет добрых 76% объема нашей атмосферы. Но, как это ни странно, живым организмам азот достается не так уж и просто. В чем же проблема? Она заключается в тройной ковалентной связи между двумя атомами азота, благодаря которой в нормальных земных условиях азот, можно сказать, инертный газ. Но давайте разбираться, как, откуда и зачем этот азот нам сдался.
Последствия заражения сернистым газом и азотом
Высокозернистый уголь, нефть, топливо — основные источники загрязнения.
Из-за задымления серным газом увеличивается заболеваемость населения бронхитом, бронхиальной астмой, энфиземой легких. Половина всех травм глаз на улице связана с попаданием в них летучей золы.
Заражение серным ангидридом можно распознать по специфическому вкусу и запаху. Он вызывает сильное раздражение слизистых.

В связи с выбросами в атмосферу оксидов серы ухудшается общее состояние организма, учащаются жалобы на головную боль, возникает тошнота, слабость, снижается работоспособность.
Оксиды серы и азота способны вызвать «кислотные» дожди. Они разрушают естественный защитный слой растений, что приводит к возникновению различных заболеваний. Кроме того, увеличивается кислотность почвы, а, следовательно, ее плодородие уменьшается. Питательные вещества, содержащиеся в почве, растворяются, тяжелые металлы переходят в растения и способны не только в дальнейшем вызвать гибель самого растения, но и навредить здоровью человека, употребившего в пищу его зараженные части.
Кислоты, которые находятся в воде, начинают взаимодействовать с кадмием, ртутью, свинцом и другими токсичными материалами, имеющимися в почве. Растворяясь под действием кислоты, они проникают в живые организмы, смешиваются с подземными водами. Человек, употребляющий зараженную воду, рискует получить заболевания почек, печени, ЦНС, онкологию.
Водные объекты, подвергшиеся окислению, превращаются в болота, что наносит непоправимый вред экосистеме водоема.
Кислотные дожди также способствуют разрушению металлических конструкций, стекла и резины.
Основные понятия
Атмосферный воздух – это жизненно важная составная часть окружающей природы. Она является смесью природных газов из приземистого атмосферного слоя, который расположен за пределами помещений для жилья и производства.
Жизнь на планете невозможна без атмосферного воздуха, как и без воды. По подсчетам ученых один человек за сутки поглощает не менее пятнадцати килограмм воздушного пространства. Атмосфера регулирует климатические и природные процессы. Она не дает произойти остыванию или перегреву Земли, и служит фильтром для проникновения ультрафиолетовых и рентгеновских лучей космоса.
Качество атмосферы напрямую зависит от ее свойств химического, физического и биологического характера.
Загрязнение – это образование в ней новых биологических или химических загрязнителей. Кроме этого, источником загрязнения считаются изменения биологических или физических свойств, негативно воздействующих на состояние здоровья людей, животных и окружающей среды.
Выхлопные газы в атмосфере городов
Наиболее опасны в городской атмосфере
выхлопные газы автомобилей, которые в больших количествах выделяются на
холостом ходу. Альдегиды, хлоруглеводороды и ароматические углеводороды имеют очень малые
значения ПДК, так как смертельно опасны для человека.
Например, в центре Москвы в часы пик,
содержание ядовитых ароматических углеводородов, являющихся составной частью
выхлопных газов, превышает ПДК в 20-30 и более раз.
Точно такая же картина наблюдается и в
других городах России. Падение качества городского воздуха происходит из-за
огромного количества выхлопных газов автомобилей.
ГН ПДК в атмосферном воздухе населенных мест 2018
Гигиенические нормы предельно допустимых
концентраций в воздухе населенных мест утверждены законодательно в
Постановлении № 165 главного государственного врача Российской Федерации,
документ от 22 декабря 2017 года. ГН действуют и в 2018 году. Некоторые ПДК
приведены в следующей таблице.
| № п/п | Вещество | ПДК м/р мг/м3 | ПДК с/с мг/м3 | Класс опасности |
| 1 | ПДК диоксида азота в атмосферном воздухе | 0,085 | 0,04 | 2 |
| 2 | Бензапирен ПДК в атмосферном воздухе | 0,1 мкг/100 м3 | 1 | |
| 3 | ПДК аммония нитрат (аммиачная селитра) | — | 0,3 | 4 |
| 4 | ПДК бензин | 5 | 1,5 | 4 |
| 5 | ПДК бензол | 1,5 | 0,1 | 2 |
| 6 | ПДК вредных веществ в атмосферном воздухе (взвешенные вещества) | 0,5 | 0,15 | 3 |
| 7 | ПДК метана в атмосферном воздухе населенных мест | — | ОБУВ 50 | — |
| 8 | ПДК нефтепродуктов в воздухе | — | — | — |
| 9 | ПДК оксида углерода в атмосферном воздухе | 5 | 3 | 4 |
| 10 | Оксид азота ПДК в атмосферном воздухе | 0,4 | 0,06 | 3 |
| 11 | ПДК хлористый водород (соляная кислота) по молекуле HCl | 0,2 | 0,2 | 2 |
| 12 | ПДК Йод | — | 0,03 | 2 |
| 13 | ПДК Кислота азотная по молекуле HNO3 | 0,4 | 0,15 | 2 |
| 14 | ПДК кислота серная по молекуле H2SO4 | 0,3 | 0,1 | 2 |
| 15 | ПДК диоксид серы | 0,5 | 0,05 | 3 |
| 16 | ПДК аммиак | 0,2 | 0,04 | 4 |
| 17 | ПДК сероводород | 0,008 | — | 2 |
| 18 | ПДК озон | 0,16 | 0,03 | 1 |
| 19 | ПДК формальдегид | 0,05 | 0,01 | 2 |
| 20 | ПДК фенол | 0,01 | 0,006 | 2 |
| 21 | ПДК толуол | 0,6 | — | 3 |
| 22 | ПДК параксилол | 0,3 | — | 3 |
| 21 | ПДК стирол | 0,04 | 0,002 | 2 |
| 22 | ПДК этилбензол | 0,02 |
— |
3 |
| 23 | ПДК нафталин | 0,007 |
— |
4 |
| 24 | PM10 | 0,3 |
0,06 |
— |
| 25 | PM2,5 | 0,16 |
0,035 |
— |
ПДК загрязняющих веществ в атмосферном воздухе населенных мест — норма качества воздуха, которым постоянно дышат люди, днем и ночью. Это важнейший фактор, влияющий на их здоровье. А здоровье человека — основополагающее требование Всемирной Организации Здравоохранения.
Впервые опасное для людей засорение атмосферного воздуха было выявлено в 1952 году в Лондоне. И сегодня в атмосферу выбрасывается огромное количество смесей всевозможных загрязнителей.
На каждого человека эти вещества оказывают влияние по-разному. Это зависит от многих факторов:
- объем легких;
- возраст;
- общее состояние здоровья;
- срок нахождения во вредной среде.
Человек, на которого действуют опасные вещества, испытывает и краткосрочные, и долговременные последствия. Это зависит от конкретных факторов и обстоятельств.
Но, так или иначе, это приводит к заболеваниям. При этом страдают легкие, сердце (возможен инфаркт), кровеносная система.
Начинается все с отделения мокроты,
переходящего в хронический кашель. Организм старается избавиться от
загрязнителей. Вскоре возможны инфекционные заболевания дыхательной системы,
рак легких, инсульт и другие заболевания.
Выхлопные газы от автомобилей провоцируют
преждевременные роды у женщин или задержку внутриутробного развития малыша.
Также они способствуют развитию бронхиальной астмы, особенно у детей с
неблагоприятной наследственностью.
Физико-химическая характеристика
Физические характеристики
| Молекулярная масса (усл. ед.) | 46,01 | Температура кипения (С) | 21 |
| Плотность пара по воздуху | 1,58 | Температура плавления (С) | -9,3 |
| Плотность (г/м3) | 1,44 | Температура разрушения (С) | 20 |
| Скорость испарения (кг*с/м3) | 0,037 | Удельная теплота парообразования (кДж/кг) | 272 |
| Давление пара (мм рт.ст.) при ну | 900 | Удельная теплоёмкость жидкости (кДж/кг*С) | 0,817 |
| Запах | резкий удушающий | Термостабильность |
Методы индикации
В воздухе: колориметрический метод, основан на поглощении двуокиси азота раствором иодида калия и определении нитрит-иона по реакции Грисса-Илосвая; чувствительность 0,05 мкг двуокиси азота в анализируемом объеме; реакцией двуокиси азота с сульфаниловой кислотой, образующаяся диазосоль дает с N-(1-нафтил)этилендиаимном красную окраску; чувствительность метода 0,05 мкг в 1 мл исследуемого раствора; с помощью аэрозольно-ионизационного газоанализатора «Нитрон» во взрывозащищенном исполнении; диапазон измерений 0-5 мг/куб.м.
Свойства и характеристики вещества
Диоксид азота активно используется при производстве серной и азотной кислоты, находится в составе ракетного топлива и различных взрывчатых смесей. Данное вещество высокотоксично (имеет максимальный класс опасности) и в небольших концентрациях сильно раздражает дыхательные пути, а также вызывает симптомы отравления. Если же его вдохнуть в большом количестве, образуется отек легких, в них происходит накопление жидкости.
Двуокись азота имеет оранжево-бурый цвет. Ее попадание в воздух в результате выбросов с промышленного источника в большом количестве вызывает сильное загрязнение атмосферы, чем существенно ухудшает экологическую ситуацию. В дальнейшем эти газы могут растворяться в воде, выпадать в виде кислотных дождей на растения, вызывать раздражение слизистых оболочек и др. В ходе взаимодействия двуокиси азота с водой происходит образование нового соединения – азотной кислоты. Она может взаимодействовать с металлами, вызывая сильное коррозионное действие. Нейтрализовать ее могут легкие щелочи.

https://youtube.com/watch?v=vQzBxvp-8-4
Как измеряют концентрацию вредных веществ
На производствах с вредными условиями работодатель обязан организовать мероприятия по контролю над чистотой воздуха. Эти задачи выполняют сотрудники отделов охраны труда.
Если на предприятии при производстве присутствуют вещества 1 класса опасности, то наблюдение осуществляется непрерывно. Для этого разработаны специальные самопишущие приборы. При превышении ПДК они подают звуковой сигнал.
Но такие приборы не всегда возможно применить. В таких случаях производят отбор проб воздуха на расстоянии 0,5 м от лица работника (зона дыхания). При производстве с повышенной опасностью пробы берут не менее 5 раз за смену.
Когда в воздухе находятся несколько однонаправленных веществ, то концентрация будет равна 1. Это такие вещества:
- различные спирты;
- фторид водорода и фтористоводородные кислоты;
- соляная кислота и формальдегид;
- серный и сернистый ангидрид;
- различные формы ароматических углеводородов;
- сероуглерод и бромистый метил.
Если в воздухе несколько опасных веществ различного направления, то при расчете объема воздуха для вентиляции учитывают опасное вещество, для которого требуется наибольшее количество воздуха.
Для того чтобы рассчитать ПДК того или иного вещества используются следующие моменты:
- условия, при которых появляется опасное вещество;
- токсичность и уровень опасного воздействия при однократном контакте с веществом;
- агрегатное состояние;
- физические характеристики;
- химическое строение.
Влияние озона на здоровье человека
Озон — неотъемлемая часть атмосферы. Тем
не менее, он активно влияет на здоровье человека. Исследования ученых доказали,
что уровень смертности людей летом существенно увеличивается при изменении
количества озона в атмосфере.
Выявлено несколько факторов, которые определяют степень воздействия озона на человека и уровень его реакции на раздражитель:
- длительность воздействия. Чем дольше человек
дышит воздухом с повышенным содержанием озона, тем сильнее его реакция на
это, тем хуже он себя при этом чувствует; - уровень содержания озона в воздухе. Чем выше концентрация,
тем большее количество людей испытывают недомогание, тем сильнее страдают
легкие; - количество вдыхаемого воздуха. Чем активнее
деятельность человека, тем глубже он дышит, тем сильнее пагубное влияние
озона на легкие.
Симптомы попадания озона в легкие:
стеснение в груди, раздражение и воспаление в легких, кашель. При исчезновении
загрязнителя из воздуха, пропадают и симптомы.
Методики исследований
АЗОТА ДИОКСИД: методики исследования в промышленных выборсах
| Номер методики | Диапазон |
|---|---|
| ПНДФ 12.10.1 | (1,0-200) мг/м3 |
| (фотометрический метод). № ЛПЭ-13/05 | — |
| Методика ООО «НПЦ«Аналитех» ДКИН.413411.001-МВИ | (0-200) млн-1 |
| РД 34.02.305-98, п.1.6 | (1,52 – 11200) мг/м3 |
| ФР.1.31.2004.01263 | (1,0-200) мг/м3 |
| МВИ № ПрВ 2000/6 (ФР.1.31.2015.20201) | — |
| Руководство по эксплуатации газоанализатора АГМ-51ОМС ДКИН.413411.001 РЭ | (0-200) млн-1 |
| СО 153–34.02.304-2003, п.1 | (1,52 – 11200) мг/м3 |
| МВИ-1-06 | (1-200) мг/м3 |
| ПНД Ф 13.1:2:3.19-98 | — |
| Газоанализатор универсальный ГАНК-4 . Паспорт КПГУ. Руководство по эксплуатации КПГУ | (0,02-1,0) мг/м3 |
| М-МВИ-173-06 ООО«Мониторинг», свид. № 242/007-06 от 25.01.2006 ФГУП им. Д.И.Менделеева». | (12-205) млн-1 |
| Руководство по эксплуатации газоанализатора ДАГ-500 | (0-1000) млн-1 |
| ФР 1.31.2011.11276 (М-18) | (0,1-140) мг/м3 |
| Руководство по эксплуатации ПЛЦК. 413411.001 РЭ многокомпонентного газоанализатора «Полар Т» | (20-1000) мг/м3 |
| Руководство по эксплуатации ЭКИТ5.940.000РЭ газоанализатора ЭЛАН | (0,21-10) мг/м3 |
| М-МВИ-172-06 (ФР.1.31.2011.11222) | (25-100) мг/м3 |
| Руководство по эксплуатации анализатора дымовых газов Testo 350 | (5-50000) ррm |
| ПНДФ 13.1.4-97 | (1-10000) мг/м3 |
| Газоанализатор «ГАНК–4» Руководство по эксплуатации КПГУ 413322 002 РЭ | (1 – 4000) мг/м3 с учетом разбавления |
| ГОСТ Р ИСО 10396-2006. инструкция по эксплуатации газоанализатора Testo-350XL. инструкция по эксплуатации газоанализатора ГАНК-4 | (0,02-6000) мг/м3 |
| ФР.1.31.2011.11222 (М-МВИ- 172-06) | (7,5-500) мг/м3 |
АЗОТА ДИОКСИД: методики исследования в атмосферном воздухе
| Номер методики | Диапазон |
|---|---|
| ФР.1.31.2009.06144 | (0,02-1,00) мг/м3 |
| Газоанализатор «ГАНК–4» Руководство по эксплуатации КПГУ 413322 002 РЭ | (0,02 – 1,0) мг/м3 |
| Руководство по эксплуатации ЭКИТ5.940.000РЭ газоанализатора ЭЛАН | (0,21-10) мг/м3 |
| РД 52.04.792-2014 (ФР.1.31.2015.19877) | (0,021-4,3) мг/м3 (разовая) |
| РД 52.04.186-89, п.5.2.1.4 | (0,02-1,40) мг/м3 |
| Руководство по эксплуатации газоан-ра «Элан» NO2 | (0,005-10) мг/м3 |
| МУ. Определение концентрации диоксида азота из одной пробы воздуха (фотометрическое определение с сульфаниловой кислотой и 1- нафтил амином). | (0,05-1,40) мг/м3 |
| Руководство по эксплуатации Газоанализатора универсального ГАНК-4 КГПУ 413322 002 РЭ | (0,02-10) мг/м3 |
| РД 52.04.792-2014 | (0,004-4,3) мг/м3 |
| ПНД Ф 13.1:2:3.19-98 | — |
АЗОТА ДИОКСИД: методики исследования в воздухе рабочей зоны
| Номер методики | Диапазон |
|---|---|
| (газоаналитической системы) фирмы «Thermo Environmental Instruments Inc», США, М-МВИ-103-02 | — |
| ПНД Ф 13.1:2:3.19-98 | — |
| Руководство по эксплуатации газоан-ра «Элан» NO2 | (0,005-10) мг/м3 |
| Руководство по эксплуатации ЭКИТ5.940.000РЭ газоанализатора ЭЛАН | (0,21-10) мг/м3 |
| МУ 4945-88 п.3.1 | (1-42) мг/м3 |
| Инструкция по эксплуатации газоанализатора ГАНК-4, Р 2.2.2006-05 прил. 9, МУ 2.2.5.2810-10 | (1-40) мг/м3 |
| Руководство по эксплуатации ГС серии ИГС-98 «Комета-М» ФГИМ 413415.001.500-006 РЭ | (2-30) мг/м3 |
| МУК 4.1.2473-09 | (1,0-20,0) мг/м3 |
Это интересно: Контузия (ушиб) головного мозга
Как уменьшить количество диоксида азота в салоне авто
Как выяснили ученые Гейдельбергского университета, обычные салонные фильтры не останавливают NO2. Зато с этой задачей прекрасно справляются угольные фильтры. Правда, при условии их регулярной замены, которую необходимо делать не реже срока, рекомендованного автопроизводителем.

Тестирование ученых проходило с помощью высокоточного оборудования, выявляющего концентрацию диоксида азота в салоне авто
Тестирование показало, что качественный угольный фильтр в состоянии блокировать попадание в салон авто до 92% диоксида азота. Однако такие фильтры все еще далеко не всегда входят в стандартную комплектацию новых автомобилей. Поэтому, можно посоветовать либо покупать авто, у которого в базовую комплектацию сразу входит салонный угольный фильтр, либо установите его в сервисе или самостоятельно.
Наилучшие результаты в борьбе с диоксидом азота в салоне авто демонстрируют салонные фильтры Bosch с активированным углем и модель FILTER+.

Салонные фильтры Bosch
Качество фильтрации угольного фильтра достигается за счет наличия дополнительного слоя активированного угля. Он изготавливается из обугленной и измельчённой скорлупы кокосовых орехов, и обладает очень высокими абсорбирующими свойствами. Площадь пор всего 1 г активированного угля составляет более 1000 м2. А уже чайная ложка имеет такую же площадь пор, как целое футбольное поле. Таким образом, угольные фильтры Bosch превосходно очищают воздух в салоне от неприятных запахов и вредных газов. Также установить такой фильтр самостоятельно может любой автолюбитель без заезда на сервис: к каждому комплекту приложена простая иллюстрированная пошаговая инструкция.

Салонный фильтр Bosch FILTER+
Самая сильная в мире защита салона авто, причем не только от диоксида азота, но и мелкой пыли и пыльцы, на сегодняшний день – это антиаллергенные фильтры FILTER+.
Эффективность фильтрации обуславливается многослойностью Filter+. Диоксид азота и неприятные запахи блокируются слоем активированного угля. Слой микрофибры не пропускает 99% мелкодисперсной пыли. Аллергены нейтрализуются слоем со специальной молекулярной сетчатой структурой, отделяющей аллергены на молекулярном уровне и делающей их безвредными. А находящиеся в этом слое ионы серебра проникают в бактерию и уничтожают её.
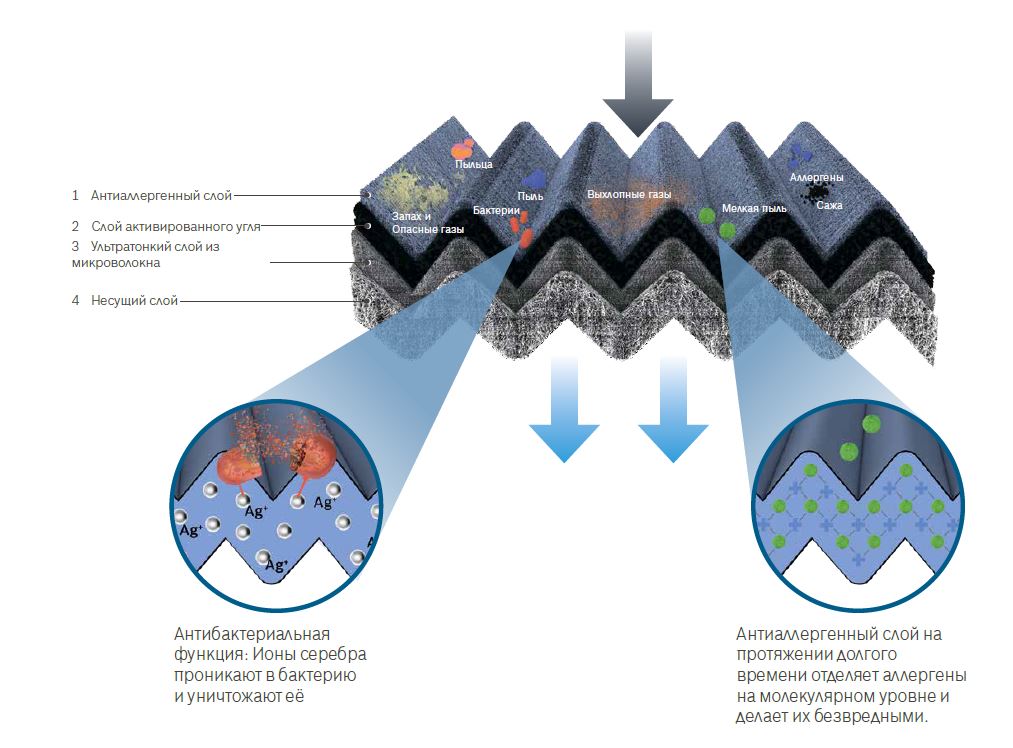
Строение салонного фильтра Filter+ компании Bosch
Главные достоинства салонных фильтров Bosch:
- фильтр FILTER способен блокировать 99% всех мелких частиц размером до 2,5 микрон;
- устраняют запотевание стекол;
- одинаково работают в низких и высоких температурных режимах;
- заменить фильтр салона самостоятельно может любой автовладелец:
- не обязательно ехать на сервис, каждый комплект снабжается простой иллюстрированной пошаговой инструкцией;
- салонные фильтры Bosch не пропускают в салон авто не только диоксид азота, но и пыльцу растений, пыль, неприятные запахи, споры и бактерии.

В итоге, эксперименты показали, что установка угольных фильтров Bosch не только практически полностью устраняют попадание диоксида азота и иных составляющих выхлопов в салон авто. Она также бережет здоровье водителей и их пассажиров, и повышает безопасность вождения.
Выводы
Как видим из вышеприведенного материала, азота диоксид в атмосферном воздухе может крайне негативно сказываться на организме человека. К сожалению, превышения допустимых концентраций этого вещества в воздухе – не редкость. Поэтому довольно актуальными на сегодняшний день являются вопросы, касающиеся разработки мероприятий, направленных на снижение выбросов диоксида азота в атмосферу, которые имеют как экологическое, так и санитарно-гигиеническое значение.
Поступление высоких концентраций азота в организм человека вызывает состояние, подобное наркозу. Опьяняющее и снотворное действие, которое проявляется в результате отравления азотом, в некоторых случаях может привести к смерти человека.
Основные сведения об азоте
Азот — химический элемент, в обычном состоянии представляет собой газ без цвета, вкуса и запаха. Является основным компонентом воздуха, которым мы дышим — 78% от всего объема. Атмосферный азот достаточно инертен, поэтому не оказывает значительного влияния на организм человека. Изменение его свойств и появление новых клинических проявлений наблюдается при повышенном давлении, после чего и может возникнуть отравление азотом. Интоксикация также возможна не чистым веществом, а его соединениями, которые в больших концентрациях очень активны и токсичны для человека.
Для организма этот элемент крайне важен, так как входит в состав белков и нуклеиновых кислот, которые являются основой структуры всех тканей. Азот необходим клеткам, некоторые его соединения расширяют кровеносные сосуды, улучшают кровообращение, уменьшают боль и проявляют другие фармакологические эффекты.
