Применение углекислого газа в промышленности
Содержание:
- Область применения показателя
- Месторождения и запасы в разных географических областях
- Органические и неорганические вещества
- Простые неорганические соединения: неметаллы
- Химические свойства
- Очищаем самогон при перегоне
- Нахождение в природе
- Причины возникновения отрыжки
- Виды угля
- Углекислый газ в природе естественные источники
- Свойства неорганических веществ
- См. также
- Каменный уголь
Область применения показателя
Определение качества воды
Показатели содержания углерода в воде являются удобным методом определения общего качества воды. Например, некоторые страны используют анализ на ООУ (TOC) в качестве первичной проверки качества сточных и питьевых вод. Оценка содержания общего органического углерода в пробе воды – удобный аналог таких методов исследования воды, как БПК (биохимическое потребление кислорода) и ХПК (химическое потребление кислорода).
Также, существует предположение, что высокое содержание органических форм углерода в сточных водах приводит к росту биоплёнок на поверхностях трубопроводов. Это вызывает загрязнение воды, может приводить к её заражению различными патогенными и условно-патогенными микроорганизмами, что становится причиной ухудшения качества воды.
Фармацевтика и биотехнологии
Ряд фармакопей – европейская, японская, американская – считает содержание ООУ в воде ценным показателем качества воды и инструментом мониторинга биохимических процессов, происходящих в ней. Поддержание низкого уровня ООУ в питьевых водах является важным приоритетом для перечисленных стран. Считается, что существует определённое соотношение между уровнем ООУ и количеством эндотоксинов и различных микроорганизмов в воде.
Фармацевтическая промышленность, использующая биохимические процессы для производства определённых продуктов, ориентируется на этот показатель для мониторинга качества протекающих технологических процессов. Примерами использования показателя ООУ в биотехнологии можно считать производство различных биофармацевтических препаратов – вакцины, соматические клетки.
Месторождения и запасы в разных географических областях
Наша страна является обладателем крупнейших месторождений голубого топлива. Далее, следуют США, Казахстан, азиатские государства бывшего СССР – Азербайджан, Узбекистан и державы Персидского Залива. Разработка месторождений осуществляется по всему земному шару. Кроме залежей на суше, активная добыча происходит и в мировом океане.
![]()
Уренгой. Это крупнейшее месторождение в России, второе по объему запасов в мире.
Находка. А также располагается в Ямало-Ненецком АО. Его разработка началась в 2004г. Объем залежей в нем оценивается около 275 миллиардов кубов.
Ангаро-Ленское – на территории Иркутской области. Результаты оценки утверждают скопление там до 1,4 триллиона кубов.
Ковыктинское – в этой же области. В связи с тем, что это месторождение расположено в зоне вечной мерзлоты, оно наиболее трудоемко в разработке. Объем залежей составляет около 2 триллионов куб. м газа и до 120 миллионов кубов конденсата в жидком состоянии.
Штокманское. Располагается недалеко от Мурманска. По предварительной оценке, там находится до 3,8 триллиона кубов. Это месторождение еще не взято в разработку по причине глубокого залегания газа.
Монополистом по части разработки газовых месторождений в нашей стране является Газпром. На его долю приходится добыча около 74% всех отечественных запасов и 20% мировых. К задачам Госпрома, кроме непосредственных функций, относится газификация государства.
![]()
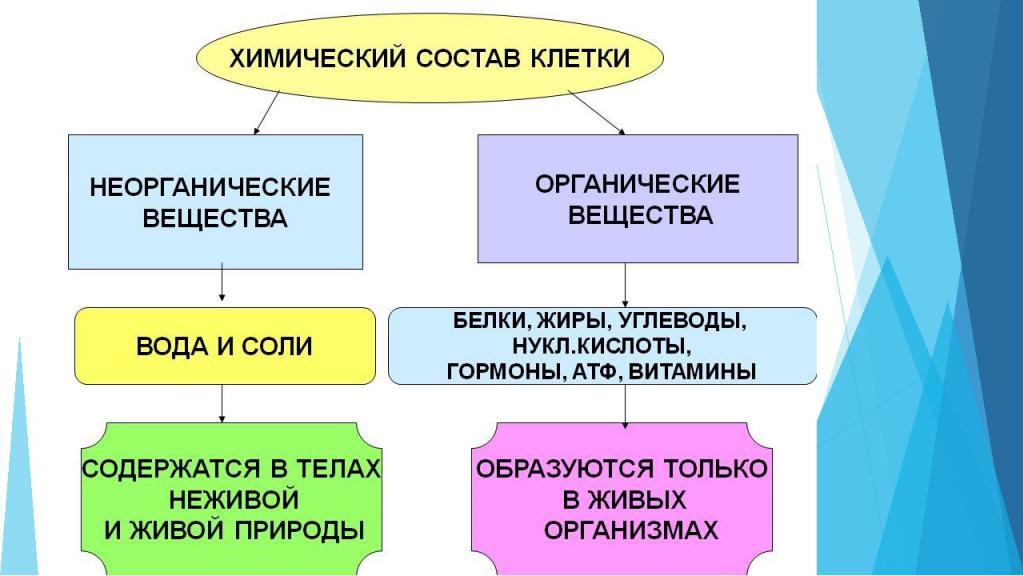
Органические и неорганические вещества
Вещества разделяют также на органические и неорганические. В состав всех органических веществ входят атомы углерода и, чаще всего, водорода. Так, из них образованы природный газ, вещества в составе нефти. В составе многих органических веществ содержатся еще и атомы кислорода. Это жиры, крахмал, сахар, уксус и другие. В состав важных для живых существ белков, кроме упомянутых элементов, обязательно входит азот.
Откуда такое название — органические вещества? Все очень просто. Первые из этих веществ ученые обнаружили в организмах — телах живой природы.
Все тела природы, за исключением горных пород, воздуха и воды, состоят из органических веществ. Среди них больше всего углеводов (например, глюкозы и сахарозы), жиров (например, масла), белков (например, белок куриного яйца).
Многие органические вещества человек создал сам, например пластмассы, резину, полиэтилен. Они широко используются в машино- и самолетостроении, при сооружении зданий и мостов, а также в быту.
Простые неорганические соединения: неметаллы
Неметаллы – химические элементы, которые не обладают металлическими свойствами. Примеры неорганических веществ:
Неметаллы отличаются большим числом электронов на внешнем энергетическом уровне их атома. Это обуславливает некоторые свойства: повышается способность присоединять дополнительные электроны, проявляется более высокая окислительная активность.
В природе можно встретить неметаллы в свободном состоянии: кислород, хлор, фтор, водород. А также твердые формы: йод, фосфор, кремний, селен.
Некоторые неметаллы имеют отличительное свойство – аллотропию. То есть они могут существовать в различных модификациях и формах. Например:
- газообразный кислород имеет модификации: кислород и озон;
- твердый углерод может существовать в таких формах: алмаз, графит, стеклоуглерод и другие.

Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации — угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция – горение магния:
2Mg + CO2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.

В химических соединениях СО2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Очищаем самогон при перегоне
Этот этап является самым ответственным. Добросовестный подход к его исполнению положительно влияет на готовый продукт. Необходимо внимательно исследовать самогонный аппарат на предмет поломки, чистоты и качества сборки. Если он имеет застоявшийся запах, он передастся напитку
Поэтому после каждого использования важно тщательно промывать все банки, трубки, шланги
Чтобы приготовить самогон без запаха в домашних условиях нужно следовать следующим принципам:
- Соблюдать температурный режим. Надо запомнить, что температуру следует поддерживать от 20 до 30 градусов. Чем она больше, тем быстрее осуществляется перегон, а также выводятся вредные вещества. Современные аппараты имеют в комплекте специализированные термометры. Для старых моделей можно их приобрести отдельно и самому дома установить на аппарат, это намного облегчит процедуру варения.
- Осветлить фруктовый и зерновой продукт для оседания ненужных веществ.
- Процедить смесь. Особенно это касается напитков с фруктами, чтобы они не пригорали и не обеспечивали напиток вонючим запахом.
- После нагрева жидкости следить, чтобы кипящие капли сусла не оказывались в спирте, это обеспечит алкоголю неприятный запах.
- Первая перегонка – самая быстрая. Она должна производиться быстро, т.к. это поможет избавить питье от сивушных масел. Длительное кипячение приведет к формированию вредных соединений, которые нужно исключить, чтобы напиток не вонял.
- После первой перегонки развести продукт водой до 20 градусов, выгнать еще раз.
На этом этапе новички используют всю жидкость, стекающую из домашнего аппарата. В итоге получается питье, которое не только сильно воняет, но и представляет опасность для жизни
Опытные производители знают, что крайне важно разделить дистиллят на фракции, отделить головы от хвостов
Головы – это жидкость, стекающая первостепенно из аппарата. В ней сосредоточено большинство сивушных масел. По составу она приближается к ацетону. Поэтому употреблять внутрь ее крайне опасно. Хвосты стекают в конце и также имеют характерный запах, хотя по крепости они слишком слабые. Эти фракции удаляются, а конечный продукт имеет хороший цвет и приятный запах.
Нахождение в природе
В природе данный газ встречается глубоко под землей, под толстыми и плотными пластами осадочных пород. Существует две основные теории происхождения природного газа в природе.
- Теория тектонических движений пород. Сторонники данной теории считают, что углеводороды содержатся в земных недрах всегда и поднимаются в результате тектонических движений и сокращений вверх. Наверху высокое давление и меняющаяся температура превращают их в результате химических реакций в два природных полезных ископаемых — нефть и газ.
- Биогенная теория говорит о другом методе, в результате которого образовался природный газ. Формула его отражает качественный состав — углерод и водород, что говорит о том, что в его образовании принимали участие живые органические существа, тела которых были большей частью построены из этих элементов, как и все живое на нашей планете, существующее до сих пор. С течением времени отмершие останки животных и растений опускались все ниже на дно океана, туда, где не существовало ни кислорода, ни бактерий, способных разложить и переработать эту органическую массу. В результате анаэробного окисления произошел распад биомассы, и за миллионы лет сформировалось два источника полезных ископаемых — нефть и газ. При этом основа и того и другого одинакова — это углеводороды и частично низкомолекулярные вещества. Химическая формула газа и нефти это доказывает. Однако при воздействии разных условий формируются и разные продукты: высокое давление и температура — газ, низкие показатели — нефть.
На сегодняшний день основными месторождениями и запасами газа обладают такие страны, как Россия, США, Канада, Иран, Норвегия и Нидерланды.
По своему агрегатному состоянию природный газ не всегда может содержаться только в состоянии газа. Есть несколько вариантов его конденсации:
- Газ растворен в молекулах нефти.
- Газ растворен в молекулах воды.
- Газ образует твердые газогидраты.
- При обычных условиях — газообразное соединение.
Каждое из этих состояний имеет свое месторождение и является очень ценным для человека.
![]()
Причины возникновения отрыжки
Чтобы узнать причину появления отрыжки, следует знать принцип функционирования пищеварительного тракта. Путь пищи заключается в следующем: в начале она попадает в пищевод, потом в желудок. Если ее большое количество, тогда часть воздуха выходит из желудка. Это не патологическое состояние, а нормальная работа желудочно-кишечного тракта, поэтому отрыжка воздухом после плотного обеда не является признаком заболевания.
Иногда реакция появляется после большой физической нагрузки, когда содержимое желудка смещается, и часть лишнего воздуха выходит. Данное явление происходит при ношении тугого ремня или узкой одежды. При этом желудок не может расшириться, и воздух выходит (такое случается в основном с полными людьми, но все же на это влияет употребление пищи). При вышеописанных состояниях отрыжка возникает редко (но у некоторых довольно часто и выявить причину этому довольно тяжело). Отрыжка – частое явление для беременных на последнем сроке (это не патология, а естественный процесс, так как увеличенная матка давит на органы).
Совсем другая ситуация складывается при утренней отрыжке перед едой, так как естественных причин этому нет, ведь желудок пуст
В таком случае человек должен обратить на это внимание. Еще большее беспокойство должно возникать, когда появляется тухлая отрыжка, или же ротовая полость наполняется кислым или горьким содержимым
Если такое возникает довольно часто, тогда необходимо обратиться за помощью к специалисту, потому что данный симптом указывает на развитие заболеваний желудочно-кишечного тракта.
На возникновение отрыжки могут влиять иные факторы, например, неправильная диета или прием пищи. Бывает так, что человек заглатывает воздух. Это случается, когда он быстро ест, при этом глотая большие не пережеванные куски. Заглатывание воздуха происходит при разговоре во время еды, жевании жевательной резинки, курении, глубоком вдохе и при частых ингаляциях во время терапии респираторных патологий. При этих действиях наблюдается большое скопление воздуха в желудке, начинающего выходить наружу обратно.
Кроме того, причиной могут быть газированные напитки, так как в них содержится много углекислого газа (попадая в желудок, он будет стараться выйти наружу). Газы в желудке собираются после употребления бобовых, жирного, крепкого чая и кофе, лука и чеснока. Чтобы устранить отрыжку необходимо убрать из рациона эти компоненты. Но следует отметить, что выраженный процесс в редких случаях является самостоятельным проявлением.
У взрослых это явление часто возникает параллельно с другими неприятными состояниями, например: изжога, тяжесть в животе, тошнота, боли в желудке.
Тогда можно предполагать, что у человека есть заболевания желудка и кишечника, а именно:
- гастрит;
- язва;
- панкреатит;
- холецистит;
- травматические и ожоговые повреждения пищевода и желудка;
- новообразование.
Виды угля
Основная статья: Маркировка угля
Уголь, подобно нефти и газу, представляет собой органическое вещество, подвергшееся медленному разложению под действием биологических и геологических процессов. Основа образования угля — битумные массы и в меньшей степени (не промышленные запасы) из органических остатков растительного происхождения. В зависимости от степени преобразования и удельного количества углерода в угле различают четыре его типа: бурые угли (лигниты), каменные угли, антрациты и графиты. В западных странах имеет место несколько иная классификация — лигниты, суббитуминозные угли, битуминозные угли, антрациты и графиты, соответственно.
По происхождению угли делятся на гумусовые
(из остатков высших растений: древесины, листьев, стеблей и т. д. ) исапропелитовые угли (из остатков низших растений, главным образом водорослей).
Антрацит
Основная статья: Антрацит
Антрацит
Антрацит
— самый глубоко прогревавшийся при своём возникновении из ископаемых углей, уголь наиболее высокой степени углефикации, переходная форма от каменного угля к графиту. Характеризуется большой плотностью и блеском. Содержит 95 % углерода. Применяется как твёрдое высококалорийное топливо (теплотворность 6800—8350 ккал/кг). Имеет наибольшую теплоту сгорания, но плохо воспламеняется. Образуется из каменного угля при повышении давления и температуры на глубинах порядка 6 километров.
Каменный уголь
Основная статья: Каменный уголь
Каменный уголь
Каменный уголь
— горная порода, представляющая собой продукт глубокого метаморфизма битумных масс, изливавшихся на поверхность планеты Земля вследствие глобальных тектонических катаклизмов в различные геологические эпохи развития планеты. Наибольший метаморфизм наблюдается вблизи образованных горных массивов, на большей глубине залегания под действием высоких температур, давления и отсутствия кислорода. По химическому составу каменный уголь представляет смесь высокомолекулярных полициклических ароматических соединений с высокой массовой долей углерода, а также воды и летучих веществ с небольшими количествами минеральных примесей, при сжигании угля образующих золу. Ископаемые угли отличаются друг от друга соотношением слагающих их компонентов, что определяет их теплоту сгорания. Ряд органических соединений, входящих в состав каменного угля, обладает канцерогенными свойствами.
Содержание углерода в каменном угле, в зависимости от его сорта, составляет от 75 % до 95 %. Содержат до 12 % влаги (3-4 % внутренней), поэтому имеют более высокую теплоту сгорания по сравнению с бурыми углями. Содержит до 32 % летучих веществ, за счёт чего неплохо воспламеняется. Образуется из бурого угля на глубинах порядка трёх километров.
Бурый уголь
Основная статья: Бурый уголь
Бурый уголь
Лигнит
Бурый уголь
— твёрдый ископаемый уголь, образовавшийся из торфа, содержит 65—70 % углерода, имеет бурый цвет, наиболее молодой из ископаемых углей. Используется как местное топливо, а также как химическое сырьё. Содержит много воды (43 %), и поэтому имеет низкую теплоту сгорания. Кроме того, содержит большое кол-во летучих веществ (до 50 %). Образуются из отмерших органических остатков под давлением нагрузки и под действием повышенной температуры на глубинах порядка одного километра.
Прочие
По составу и происхождению различают прочие разновидности углей:
альгинит, альгогелит, альгоколлинит, аттросеминит, богхед, витрен, витринит, гагат, гелит, гелитит, гелитолит, гумит, гумолит, десмит, дюрен, дюрит, интертинит, кальгинит, кардиф, касьянит, каустобиолит, кеннель, кларен, коллинит, коллоальгинит, коллоальголит, коллосеминит, коллофюзинит, кольм, ксилен, ксилинит, ксилоаттрит, ксиловитрен, ксилодесмит, кульм, кутинит, лейптинит, лигнит, лигнитит, липоид, липоидолит, липоидотит, липтобиолит, литотип, лопинит, метаантрацит, микринит, микстогумитит, микстогумолит, микстонит, паренхит, полуантрацит, резинит, сапрогумолит, сапроколлит, сапропелит, семиантрацит, семивитринит, семиколлинит, семинит, семителинит, семифюзен, семифюзинит, склеротинит, споринит, спорополинит, суберинит, тальгинит, телинит, телломоальгинит, телоколлинит, телосименит, телофюзинит, ультрадюрен, ультракларен, феллинит, фитерал, фюзен, фюзенит, фюзенолит, фюзинит, фюзит, фюзитит, черемхит, экзинит, электроуголь, юмит и другие.
Углекислый газ в природе естественные источники
К таким источникам относятся окислительные процессы разной интенсивности:
- Дыхание живых организмов. Из школьного курса химии и ботаники все помнят, что в ходе фотосинтеза растения поглощают углекислый газ и выделяют кислород. Но не все помнят, что это происходит только днем, при достаточном уровне освещения. В темное время суток растения наоборот, поглощают кислород и выделяют углекислый газ. Так что попытка улучшить качество воздуха в комнате, превращая ее в заросли фикусов и герани может сыграть злую шутку.
- Извержения и другая вулканическая активность. CO2 выбрасывается из глубин мантии Земли вместе с вулканическими газами. В долинах рядом с источниками извержений газа настолько много, что, скапливаясь в низинах, он вызывает удушье животных и даже людей. Известны несколько случаев в Африке, когда задыхались целые деревни.
- Горение и гниение органики. Горение и гниение — это одна и та же реакция окисления, но протекающая с разной скоростью. Богатые углеродом разлагающиеся органические остатки растений и животных, лесные пожары и тлеющие торфяники — все это источники диоксида углерода.
- Самым же большим природным хранилищем CO2 являются воды мирового океана, в которых он растворен.

Углекислый газ в природе
За миллионы лет эволюции основанной на углеродных соединениях жизни на Земле в различных источниках накопились многие миллиарды тонн углекислого газа. Его одномоментный выброс в атмосферу приведет к гибели всего живого на планете из-за невозможности дыхания. Хорошо, что вероятность такого одномоментного выброса стремится к нулю.
Свойства неорганических веществ
Все рассмотренные вещества отличаются индивидуальными химическими и физическими свойствами. В общем виде можно выделить отличительные черты каждого класса неорганических веществ:
- высокая тепло- и электропроводность;
- металлический блеск;
- отсутствие прозрачности;
- прочность и пластичность;
- при комнатной температуре сохраняют твердость и форму (кроме ртути).
- простые неметаллы могут быть в газообразном состоянии: водород, кислород, хлор;
- в жидком состоянии встречается бром;
- твердые неметаллы имеют немолекулярное состояние и могут образовывать кристаллы: алмаз, кремний, графит.
- оксиды: вступают в реакцию с водой, кислотами и кислотными оксидами;
- кислоты: вступают в реакцию с водой, основными оксидами и щелочами;
- амфотерные оксиды: могут вступать в реакции с кислотными оксидами и основаниями;
- гидроксиды: растворяются в воде, имеют широкий диапазон температур плавления, могут менять цвет при взаимодействии с щелочами.
См. также
Wikimedia Foundation . 2010 .
Смотреть что такое «Неорганические вещества» в других словарях:
НЕОРГАНИЧЕСКИЕ МАТЕРИАЛЫ — неорганические вещества с функциональными свойствами. Различают металлические, неметаллические и композиционные материалы. Примеры сплавы, неорганические стекла, полупроводники, керамика, керметы, диэлектрики … Большой Энциклопедический словарь
Неорганические соединения — Неорганические вещества – это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к… … Википедия
Неорганические кислоты — Основная статья: Кислота Неорганические (минеральные) кислоты неорганические вещества, обладающие комплексом физико химических свойств, которые присущи кислотам. Вещества кислотной природы известны для большинства химических элементов за… … Википедия
неорганические материалы — неорганические вещества с функциональными свойствами. Различают металлические, неметаллические и композиционные материалы. Примеры сплавы, неорганические стёкла, полупроводники, керамика, керметы, диэлектрики. * * * НЕОРГАНИЧЕСКИЕ МАТЕРИАЛЫ… … Энциклопедический словарь
Неорганические полимеры — Полимеры с неорганической (не содержащей атомов углерода) главной цепью макромолекулы (См. Макромолекула). Боковые (обрамляющие) группы обычно тоже неорганические; однако полимеры с органическими боковыми группами часто также относят к Н … Большая советская энциклопедия
Вещества красящие — Вещества красящие – вводят в композицию для придания изделию необходимого колера. В производстве пластмасс используют неорганические пигменты – охру, мумию, сурик, умбру, ультрамарин, оксид хрома и др. и органические – нигразин, хризоидин.… … Энциклопедия терминов, определений и пояснений строительных материалов
ВЕЩЕСТВА ВЗВЕШЕННЫЕ — органические и неорганические частицы, содержащиеся в воде во взвешенном состоянии. Наиболее характерное взвешенное вещество естественных водоемов детрит. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской… … Экологический словарь
Неорганические азиды — Азиды химические соединения, производные азотистоводородной кислоты HN3. Содержат одну или несколько групп N3. Содержание 1 Азиды металлов 2 Азиды неметаллов … Википедия
Неорганические тела — см. Органические вещества … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — К неорганическим относятся соединения всех химических элементов, за исключением большинства соединений углерода. Кислоты, основания и соли. Кислотами называются соединения, которые в воде диссоциируют с высвобождением ионов водорода (Н+). Эти… … Энциклопедия Кольера
Источник
Каменный уголь
Результатом следующего «шага» метаморфоз, происходящих при образовании угля, является каменный уголь. Этот вид угля образовывался на более глубоких уровнях, под большим давлением и при высокой температуре. Соответственно, его химический состав и физические характеристики уже существенно отличаются.
Химический состав каменного угля представляет собой смесь высокомолекулярных ароматических соединений с высоким содержанием углерода, летучих веществ и влаги. Также в каменном угле содержатся некоторые минеральные примеси, которые после сжигания угля образуют золу. В зависимости от сорта каменного угля, содержание в нем углерода может варьироваться от 75% до 95%. За счет более низкого содержания влаги, чем в буром угле, каменный уголь имеет более высокую теплоту сгорания. Каменный уголь содержит до 32% летучих веществ, которые обеспечивают неплохое воспламенение.
Разновидности каменного угля
Основой промышленной классификации каменного угля в разных странах принимаются разные параметры состава и свойств угля. Так, в США каменный уголь классифицируется по критериям теплоты сгорания, содержания связанного углерода и относительного содержания летучих веществ. Япония классифицирует каменный уголь по так называемому топливному коэффициенту (по сути, по той же теплоте сгорания) и крепости получаемого кокса (или неспособности к коксованию).
Наша страна унаследовала классификацию, которая была выработана в СССР. До 1954 года в Советском Союзе основой промышленной классификации каменных углей была так называемая Донецкая классификация. Ее называют «марочной». Одновременно она является генетической (так классифицируется каменный уголь ГОСТ 25543-88 по технологическим и генетическим параметрам), так как возложенные в ее основу метаморфозы свойств углей, отражают их изменения, которые обусловлены генетическим развитием органических веществ угля. Для промышленной маркировки каменного угля из разных бассейнов в СССР использовались утвержденные стандартизированные классификации.
По характеру нелетучего остатка (иногда дополнительно к учету спекаемости и величины теплоты сгорания) и усредненной величине выхода летучих веществ каменный уголь делится на 10 марок:
- длиннопламенные (Д);
- газовые (Г);
- газовожирные (ГЖ);
- жирные (Ж);
- коксовые жирные (КЖ);
- коксовые (К);
- коксовые вторые (К2);
- слабоспекающие (СС);
- отощенные спекающиеся (ОС);
- тощие (Т).
Содержание углерода последовательно увеличивается от 76% до 92% от марки Д до марки Т. Одновременно уменьшается выход летучих веществ до 7-12%. В каждой из марок выделяется несколько технологических групп (кроме марок Д и Г).
Области применения каменного угля
Каменный уголь является очень востребованным сырьем, поэтому поставка каменного угля осуществляется многими компаниями практически непрерывно.
Каменный уголь находит самое разнообразное применение. Его используют в качестве технологического, энерготехнологического и энергетического сырья. При производстве кокса и полукокса побочными продуктами переработки каменного угля являются многие химические продукты (фенолы, нафталин, лак и пр.). На их основе получают пластмассы, синтетические волокна, лаки, краски, удобрения и многие другие важные и ценные продукты.
Одно из самых перспективных направлений использования каменных углей – это сжижение (гидрогенизация) для получения жидких топлив. Результатом переработки каменного угля также являются активированные угли, искусственные графиты и другие продукты. При переработке каменного угля в больших масштабах получают важные химические элементы: молибден, цинк, ванадий, свинец.
Существуют самые разные схемы неэнергетического применения каменного угля на основе химической, термохимической и других видов переработки с целью его полного комплексного использования. Более подробно эта тема раскрыта в соответствующей статье.
