Почему нашатырный спирт приводит в чувства
Содержание:
- Аммиак. Опасен при вдыхании и незаменим в промышленности
- Химические свойства аммиака:
- Необходимость утилизации аммиака как высокотоксичного вещества согласно закону от 04.05.1999 N 96-ФЗ «Об охране атмосферного воздуха»
- Как правильно утилизировать аммиак и его отходы на предприятиях
- Симптомы и признаки отравление парами
- Профилактика
- Последствия поражения организма аммиаком
- Физиологическое действие и токсикология[править | править код]
- Комплексообразование
- Лечение при отравлении
- Структура молекулы аммиака
- Косметика и эфирные масла
- Комплексообразование[править | править код]
- Лечение пациента в токсикологии
- Физическое воздействие
- Получение аммиака в промышленности и лаборатории. Химические реакции – уравнения получения аммиака:
- Строение
- Противопоказания и побочные эффекты
- Аммиак, формула, газ, характеристики:
- Химические свойства[править | править код]
- Аммиак в медицине[править | править код]
- Происхождение названия
Аммиак. Опасен при вдыхании и незаменим в промышленности
При отравлении аммиаком необходимо принять следующие меры:
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
Индивидуальная защита: изолирующий и фильтрующие противогазы марок М, КД, респиратор РПГ-67КД, при их отсутствии — ватно-марлевая повязка, смоченная 5% раствором лимонной кислоты, защитный костюм, резиновые сапоги, перчатки.
Действия общего характера: удалить посторонних. Держаться с наветренной стороны.
Изолировать опасную зону и не допускать посторонних. В зону аварии входить только в полной защитной одежде. Соблюдать меры пожарной безопасности, не курить.
При утечке и разливе: устранить источники открытого огня. Устранить течь. Для осаждения газов использовать распыленную воду. Оповестить об опасности отравления местные органы власти. Эвакуировать людей из зоны, подвергшейся опасности заражения ядовитым газом. Не допускать попадания вещества в водоемы, тоннели, подвалы, канализацию. В случае загрязнения воды сообщить СЭС.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Случаи утечки аммиака
В декабре 1999 года в Калининградской области в приграничном с Литвой городе Советске на целлюлозно-бумажном комбинате произошла авария, в результате которой из резервуаров на почву вытекло более 100 тонн аммиачной воды.
В мае 2000 года в Черкасской области Украины в результате железнодорожной аварии из двух вагонов-цистерн вылилось около 100 тонн аммиачной воды.
В апреле 2001 года на холодильной установке в колбасном цехе ОАО «Поиск» в Томске произошел взрыв емкости с аммиаком. В момент взрыва в цехе находились 40 человек, шестеро из них получили ранения.
В сентябре 2005 года произошел аварийный выброс аммиака на Калининградском мясокомбинате.
В июле 2006 аварийный выброс аммиака произошел в г. Корсакове Сахалинской области. На территории предприятия «Корсаковский рыбоконсервный завод» при замене сальника на вентиле трубопровода, соединяющего емкость для хранения аммиака с компрессором, произошел выброс аммиака в объеме до 70 кг. В результате выброса пострадало 3 человека.
В январе 2007 года на северо-востоке Москвы три человека пострадали в результате утечки аммиака. На территории завода железобетонных конструкций были обнаружены 20 баллонов с аммиаком. Из баллона, в котором еще находился аммиак, произошла утечка, и образовалось небольшое аммиачное облако.
В феврале 2007 года в Дзержинске Нижегородской области произошел выброс аммиака из теплообменника в цехе этанол-амина ООО «Синтез-Ока». Утечка произошла в результате разгерметизации фланцевого соединения аппарата Т-12, предназначенного для испарения аммиака.
Области применения аммиака
Аммиак — один из самых важных продуктов химической промышленности.
Большая часть получаемого в промышленности аммиака идёт на приготовление азотной кислоты, азотных удобрений, красителей. Применяется аммиак и для получения взрывчатых веществ. Широко используются водные растворы аммиака. Как слабое летучее основание, он применяются в химических лабораториях и производствах. С помощью аммиака получают пищевую соду.
В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного спирта.
При пайке металлов используют хлорид аммония — нашатырь — NH4Сl. При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
При испарении жидкого аммиака поглощается большое количество теплоты, поэтому его используют в холодильных установках.
Все справки>>
Химические свойства аммиака:
Основные свойства аммиака обусловлены наличием неподеленной пары электронов у атома азота. Степень окисления азота в аммиаке «-3» – минимальная. Поэтому в химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия со многими веществами и проявляет только восстановительные свойства.
Для аммиака характерны следующие химические реакции:
1. реакция взаимодействия аммиака и воды:
NH3 + H2O ⇄ NH3•H2O.
В результате реакции образуется гидрат аммония (NH3•H2O или NH4OН). Раствор аммиака в воде имеет щелочную среду.
NH3•H2O → NH3 + H2O (to).
При кипении гидрат аммиака разлагается с образованием аммиака и воды.
2. реакция взаимодействия аммиака и ортофосфорной кислоты:
NH3 + H3PO4 → NH4H2PO4.
В результате реакции образуется дигидрофосфат аммония.
Аналогичным образом протекают реакции аммиака с другими кислотами – с образованием солей аммония.
3. реакция взаимодействия аммиака и кислорода – горения аммиака:
4NH3 + 3O2 → 2N2 + 6H20.
В результате реакции образуется азот и вода. Реакция носит необратимый характер.
4. реакция каталитического окисления аммиака:
4NH3 + 5O2 → 4NO + 6H2O (kat = Pt и пр., t = 800 оС);
NH3 + 2O2 → HNO3 + H2O (kat = Pt, Rh, t = 850 оС, p = 5 атм.).
В результате первой реакции образуются оксид азота (II) и вода. В качества катализатора используются платина и ее сплавы с металлами-платиноидами, оксиды железа, марганца, кобальта, хрома и др.
В результате второй реакции образуются азотная кислота и вода. Это промышленный способ получения азотной кислоты. При этом смесь воздуха с 10% (по объему) аммиака пропускается над рядами металлических сеток (платина с 5-15% родия) при температуре около 850 оС и давлении 5 атм; время контактирования с катализатором ограничено до ≤ 1 мс чтобы минимизировать нежелательные побочные реакции. Степень превращения составляет около 96% (одна из наиболее эффективных из известных промышленных каталитических реакций); выходящие газы пропускают через абсорбционную колонну и получают 60%-й водный раствор азотной кислоты при 40°C. Реакция протекает в три стадии.
5. реакция взаимодействия аммиака и оксида меди:
2NH3 + 3CuO → N2 + 3Cu + 3H2O (t = 500-550 оС).
В результате реакции образуются азот, медь и вода. В ходе реакции аммиак пропускается через нагретый оксид меди.
6. реакция термического разложения аммиака:
2NH3 ⇄ N2 + 3H2 (t = 1200-1300 оС).
В результате реакции образуются азот и водород.
7. реакция взаимодействия аммиака и фтора:
2NH3 + 3F2 → 6HF + N2 (tо).
В результате реакции образуются фтороводород и азот. Реакция происходит при высоких температурах.
Аналогичным образом протекают реакции аммиака с другими галогенами.
8. реакция взаимодействия оксида калия и аммиака:
K2O + NH3 → KNH2 + KOH (t = -50 оС).
В результате реакции образуются амид калия и гидроксид калия. Реакция медленно протекает в жидком аммиаке.
Необходимость утилизации аммиака как высокотоксичного вещества согласно закону от 04.05.1999 N 96-ФЗ «Об охране атмосферного воздуха»
Законодательная база позволяет создать условия для поддержания основных параметров окружающей среды на нормальном уровне. Аммиак применяется во многих отраслях промышленности.
Нитрид водорода поражает наружные покровы, нервную систему, негативно влияет на зрение т. д. При попадании в водоемы, воздух гибнут живые организмы. Учитывая, что это соединение часто применяется во благо общества, полностью вывести его из эксплуатации невозможно. По этой причине нужно разрабатывать новые и совершенствовать имеющиеся методы, технологии по обезвреживанию нитрида водорода.
 Массовая гибель рыбы, вызванная сбросом аммиака в реку
Массовая гибель рыбы, вызванная сбросом аммиака в реку
Как правильно утилизировать аммиак и его отходы на предприятиях
Организуется процесс вывоза отработанных компонентов. Для этого следует изучить, какие услуги предоставляют компании данной сферы. Выбрав подходящую организацию, оформляют документацию для дальнейших работ.
Интенсивность запаха аммиака высокая (в 1,5 раза выше нормы). Кроме того, газ отличается летучестью, он токсичен. Значит, хранить его нужно в отдельном помещении. Причем доступ к веществу ограничивается: к операциям с аммиаком допускаются ответственные лица.
 Временное хранение аммиака
Временное хранение аммиака
Подготовить пакет документов для передачи отхода специализированной компании
Нитрид водорода относится к отходам, которые должны проходить процедуру утилизации. Чаще всего для этого приходится обращаться к услугам компаний, занимающихся вывозом, переработкой мусора. Передать нитрид водорода можно при наличии паспорта. Этот документ подтверждает принадлежность к 4 классу опасности, оформляется на основании результатов анализа, выполненного аккредитованной лабораторией.
 Для передачи аммиачных отходов необходим паспорт отходов
Для передачи аммиачных отходов необходим паспорт отходов
Оформить договор с компанией, которая сможет утилизировать эти отходы
Чтобы организация регулярно вывозила отходы, заключается договор. Он содержит информацию: тип веществ, которые будут транспортироваться, график вывоза, обязанности и права сторон.
 К договору прикладывается копия лицензии
К договору прикладывается копия лицензии
Симптомы и признаки отравление парами
Как проявляется отравление веществом? В зависимости от причины интоксикации симптомы различаются
На что обратить внимание? Происходит при длительном вдыхании паров аммиака. Характеризуется рядом определенных признаков
Признаки:
- Появление кашля, проблемы с дыханием, удушье,
- Нервное возбуждение,
- Спазматические явления в бронхах,
- Хрипы в легких,
- Кружение головы, нарушение координации,
- Сбои в работе зрительной системы,
- Нарушение работы сердечной системы,
- Тошнота, рвотные позывы.
- Состояние бреда, наличие галлюцинаций,
- Потеря сознания, обмороки,
- Наличие панических атак,
- Жар в теле.

При наличии заболеваний дыхательной и сердечной системы возможно развитие необратимых последствий при отравлении. Длительное вдыхание паров способно привести к развитию летального исхода.
Профилактика
Вред аммиака легче предупредить, чем долгие годы ощущать на себе последствия отравления парами или жидкостью. Профилактические меры следует соблюдать при хранении нашатыря в домашних условиях, работая с ним на производстве:
- При смешивании красящего состава все действия проводятся в защитной маске.
- Обработку зеркал или чистку пятен осуществляют в резиновых перчатках.
- Тара должна герметично закрываться, исключать случайное проливание.
- Не применять народные рецепты, содержащие этот компонент.
- Надежно спрятать пузырек с аммиачным составом от детей и людей со слабым зрением.
Состав резко пахнет, но алкоголики часто путают его со спиртосодержащими настойками. Поэтому не следует хранить средство в домашней аптечке или холодильнике. При работе с опасным веществом необходимо придерживаться разработанных инструкций.

Последствия поражения организма аммиаком
Если контакт с аммиаком был длительный и его концентрация превышала допустимые значения в несколько раз, возможны последствия, которые усугубят жизнь человеку:
- Полная потеря зрения при попадании вещества на слизистую глаз и ее ожог.
- Патологии дыхательных органов, приводящие к частым болезням из-за снижения иммунитета.
- Развитие болезней в ЖКТ.
- Нарушения неврологического характера, потому что аммиак воздействует губительно на клетки нервной ткани.
- Потеря памяти, снижение концентрации внимания, рассеянность.
- Головные боли.
- Летальный исход, если помощь оказана поздно или степень интоксикации высокая.
Предотвратить последствия может только профилактика и соблюдение банальных мер безопасности.
Физиологическое действие и токсикология[править | править код]
Аммиак относится к токсичным веществам, по ГОСТ 12.1.007-76 его относят к 4-му уровню опасности.
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³.
Предельно допустимая концентрация аммиака в воздухе рабочей зоны производственного помещения (ПДКр.з.) составляет 20 мг/м³. В атмосферном воздухе населённых пунктов и в жилых помещениях среднесуточная концентрация аммиака (ПДКс.с.) не должна превышать 0,04 мг/м³. Максимальная разовая концентрация в атмосфере — 0,2 мг/м³. Таким образом, ощущение запаха аммиака свидетельствует о превышении допустимых норм.
Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м³, глаз — 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м³ — эритематозный, 21 г/м³ и более — буллёзный дерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Туркестанской (ранее — Южно-Казахстанской) области Казахстана.
Комплексообразование
Благодаря своим электронодонорным свойствам молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
-
- CuSO4 + 4NH3 ⟶ [Cu(NH3)4]SO4.
- Ni(NO3)2 + 6NH3 ⟶ [Ni(NH3)6](NO3)2.
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет (CuSO4) переходит в тёмно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной ( Ni(NO3)2 ) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Лечение при отравлении
Чтобы устранить негативные последствия интоксикации, нужно вывести токсины и нормализовать работу пораженных органов. Лечение включает применение анальгетиков, препаратов от ожогов, противоотечных средств.
При попадании вредного вещества в организм следует придерживаться строгой диеты. Это позволяет нормализовать работу органов, которые пострадали от токсического действия аммиака. К ним относят желудок, почки и печень.
Обязательным элементом терапии является выведение токсичных элементов из кишечника. Нередко интоксикация сопровождается интенсивной диареей. Иногда в каловых массах можно найти кровянистые примеси.
Структура молекулы аммиака
Молекула аммиака соответствует трехсторонней пирамиде
(тригонально-пирамидальная). Состоит из тетраэдра, в которой свободная (не
связанная) электронная пара азота занимает угол.
N-H-связывающие электроны и неподеленная пара максимально
удалены друг от друга. Из-за более высокой электроотрицательности азота по
сравнению с водородом существует более высокая плотность отрицательного заряда
вблизи неподеленной пары электронов. Одинокая пара электронов может смещаться
на противоположную сторону, что приводит к «колебанию» молекулы, которое можно
сравнить со складыванием зонта.
Это также относится и к соединениям, полученным из аммиака
(например, аминов), если только им не препятствует «раскачивание» из-за жесткой
геометрии остальной части молекулы.
Косметика и эфирные масла
т. д.) . Трупы павших, сбитых на дорогах и усыпленных домашних животных — об этом писала газета San Francisco Chronicle, производители кормов сей факт гневно опровергали, а Американская медицинская ветеринарная ассоциация его подтвердила. Просроченные мясные продукты из супермаркетов. Поскольку большинство фирм, производящих корма, являются филиалами гигантов пищевой промышленности, перерабатывая таким образом побочные продукты основного производства они практически добиваются безотходности.
Рекомендуем прочесть: Время тишины в татарстане
Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину) . Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Комплексообразование[править | править код]
Благодаря своим электронодонорным свойствам молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
-
- CuSO4+4NH3⟶Cu(NH3)4SO4{\displaystyle {\ce {CuSO4 + 4NH3 -> SO4}}}.
- Ni(NO3)2+6NH3⟶Ni(NH3)6(NO3)2{\displaystyle {\ce {Ni(NO3)2 + 6NH3 -> (NO3)2}}}.
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет (CuSO4{\displaystyle {\ce {CuSO4}}}) переходит в тёмно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2{\displaystyle {\ce {Ni(NO3)2}}}) в сине-фиолетовую. Наиболее прочные комплексы с NH3{\displaystyle {\ce {NH3}}} образуют хром и кобальт в степени окисления +3.
Лечение пациента в токсикологии
- Терапия при аммиачной интоксикации начинается еще в машине скорой помощи. Проводится первичный осмотр с замером давления, частоты сердечных сокращений, состояния слизистых.
- Пострадавшего подключают к кислородной маске.
- Вводят лекарственный антидот аммиака под названием Атропин.
- Ставят капельницу с раствором для компенсации водно-щелочного, калиевого баланса в организме.
- При пероральном отравлении может быть начата процедура промывания через зонд.
После выполнения первых процедур пострадавшего госпитализируют в отделение токсикологии, где проводится основное лечение. Дальнейший сценарий лечения зависит от способа интоксикации аммиаком и концентрации вещества, попавшего в кровь, на слизистые, во внутренние органы или на кожные покровы. Первые сутки назначается постельный режим и ведется мониторинг состояния пациента.
К работе подключается офтальмолог, если повреждены глаза. Принимаются меры по сохранению зрения, потому что риск ослепнуть очень большой. При пневмонии, ларингоспазме показана терапия антибиотиками, применение небулайзера. Отравлении аммиаком провоцирует нарушения в области неврологии, что требует симптоматической терапии для снятия нервного напряжения и других симптомов.
Физическое воздействие
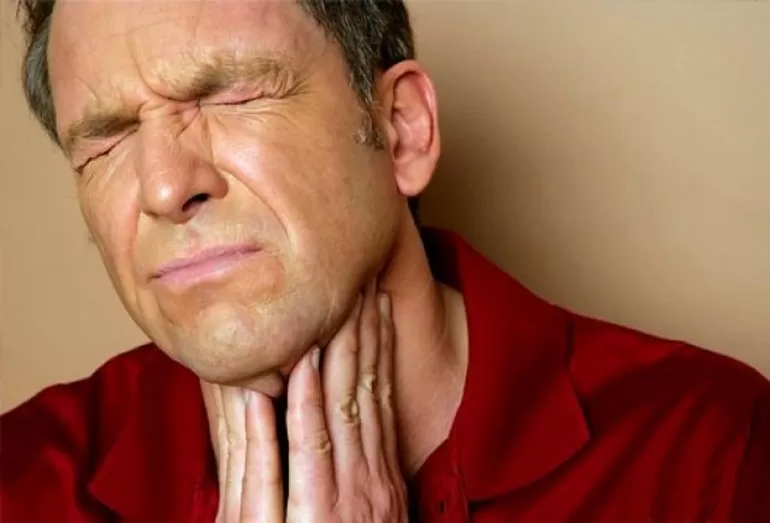
По физическим свойствам аммиак относится к веществам, обладающим удушающими характеристиками и действием на нервную систему. При попадании в область дыхательных путей способен токсинами поразить легкие и вызвать отек с поражением разных систем живого организма. По виду действия может быть местного применения и резорбтивного.
Аммиачные пары раздражает слизистую оболочку глаза и кожные покровы. Процесс протекает с сильным неприятным запахом. Вследствие воздействия пара происходит обильное выделение слез и боли в области лица. В результате появляется ожог роговицы глаза. Зрение человека ухудшается или происходит полная его потеря. Следом наступает приступ кашля, изменение цвета кожного покрова с сильным раздражением.
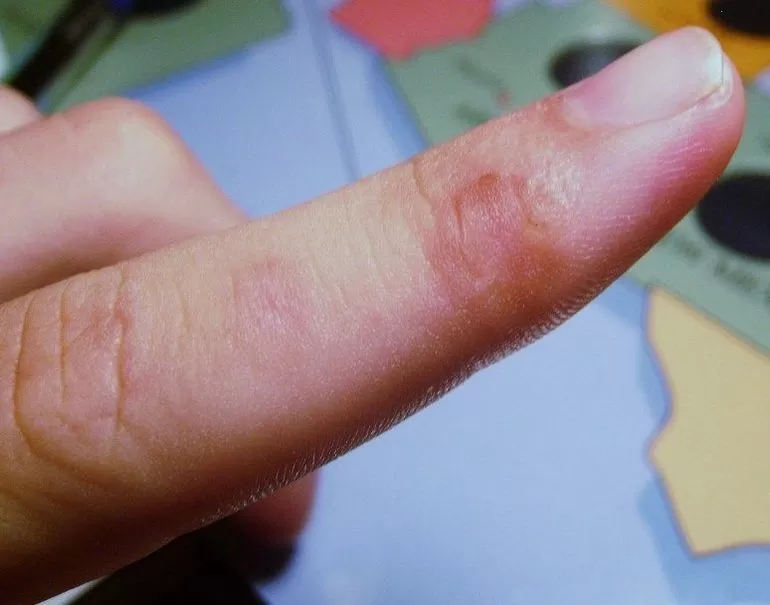
Во время попадания раствора на кожу происходит жжение пораженной поверхности и образование пузырей и изъязвлений. По своим свойствам в сжатом состояние во время процесса испарения поглощает тепло. Попадая на кожу, химический элемент способен вызвать отморожение разной степени. Наличие запаха ощущается при концентрации 37 миллиграмм на метр кубический.
Норма концентрации аммиака на рабочем месте не должна превышать 20 миллиграмм на метр кубический. Работать при более тяжелых условиях без средств индивидуальной защиты запрещено.
Получение аммиака в промышленности и лаборатории. Химические реакции – уравнения получения аммиака:
Аммиак в лабораторных условиях получается в результате следующих химических реакций:
- 1. действия гидроксида натрия на хлорид аммония:
NH4Cl + NaOH → NH3 + NaCl + H2O.
В результате реакции образуются газообразный аммиак, хлорид натрия и вода.
- 2. действия гидроксида кальция на сульфат аммония:
(NH4)2SO4 + Ca(OH)2 → 2NH3 + CaSO4 + 2H2O.
В результате реакции образуются газообразный аммиак, сульфат кальция и вода.
- 3. действия гидроксида кальция на хлорид аммония:
NH4Cl + Ca(OH)2→ 2NH3 + CaCl2 + 2H2O.
В результате реакции образуются газообразный аммиак, хлорид кальция и вода.
Таким образом, для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония.
Аммиак в промышленности получают путем прямого взаимодействия водорода и азота:
N2 + 3H2 2NH3 (kat = пористое железо с примесями Al2O3 и K2O, t = 500 оС, p = 350 атм.).
За счет высокого давления равновесие в указанной реакции смещается в сторону аммиака. Это так называемый процесс Габера. Немецкий физик Фриц Габер разработал физико-химические основы данного метода.
Строение
Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
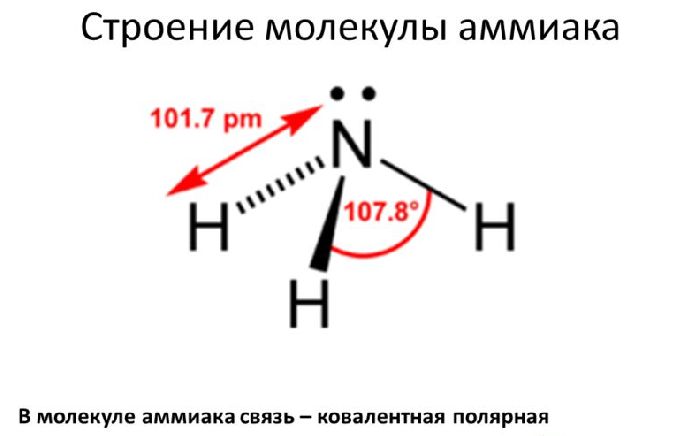 Рис. 1. Строение молекулы аммиака.
Рис. 1. Строение молекулы аммиака.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – CH3NH2);
- вторичные (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.
 Рис. 2. Образование аминов.
Рис. 2. Образование аминов.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Противопоказания и побочные эффекты
Нельзя начинать лечение нашатырным спиртом:
- при гипертонии;
- эпилепсии (категорически запрещено вдыхать пары);
- рефлекторной проводимости от афферентных рецепторов носовых пазух к головному мозгу;
- с повреждениями кожи (дерматиты, экземы, язвы, ранки и царапины) – нашатырь действует раздражающе (оставит боль и ожог);
- при индивидуальной непереносимости.
Чтать также: Зависимость от первой любви

От нашатырного спирта может остаться ожог
Раствор аммиака объединил в себе полезные свойства аналептика, антисептика и антимикозного средства за счёт щелочной природы. Помните о мерах безопасности при обработке ногтей и кожи. Лечение с нашатырём успешно используют самостоятельно или в паре с другими препаратами.
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:

Форма молекулы аммиака напоминает тригональную пирамиду, в вершине которой расположен атом азота. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
@ https://www.youtube.com/watch?v=SCTa_LD3Czw
Аммиак – при нормальных условиях бесцветный газ, с резким характерным запахом (запах «нашатырного спирта»).
Аммиак – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,59. Таким образом, аммиак практически вдвое (в 1,7 раза) легче воздуха. Его можно собирать в перевернутые вверх дном сосуды.
Аммиак – это горючий газ. Пожаро- и взрывоопасен. В чистом кислороде аммиак сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Аммиак горит при наличии постоянного источника огня. Наличие масел и другого горючего увеличивает пожаровзрывоопасность этого вещества.
Аммиак образует с воздухом взрывоопасную смесь. Концентрационные пределы распространения пламени – 15,0-33,6 объемные доли, %; либо 107-240 г/м3. Наиболее легковоспламеняемая концентрация 24,5% (180 г/м3).
Хорошо растворим в воде как в газообразном, та и в жидком состоянии. Растворимость NH3 в воде чрезвычайно велика – около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. При растворении аммиака в воде выделяется значительное количество тепла.
Водный раствор аммиака имеет сильную щелочную реакцию вследствие образования гидроокиси аммония NH4OH.
Аммиак относится к токсичным веществам, к IV классу опасности (малоопасные вещества) по ГОСТ 12.1.007. ПДК аммиака в атмосферном воздухе населенных мест по ГОСТ 6221-90 составляет: максимально разовая – 0,2 мг/м3; среднесуточная – 0,04 мг/м3. Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения (ПДКр.з.) по ГОСТ 12.1.005-88 составляет 20 мг/м³. Ощущение запаха аммиака свидетельствует о превышении допустимых норм, т.к. запах аммиака ощущается при концентрации 37 мг/м³.
Газообразный аммиак вызывает острое раздражение слизистых оболочек, слезотечение, отравление и удушье. Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Аммиак в следовых количествах содержится в природе и планетах Солнечной системы. Почки человека выделяют аммиак для нейтрализации избыточной кислоты.
Ежегодное мировое промышленное производство аммиака составляет более 180 млн тонн. Он относится к числу важнейших продуктов химической промышленности. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Химические свойства[править | править код]
-
- NH3+H+⟶NH4+{\displaystyle {\ce {NH3 + H+ -> NH4+}}}.
Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
-
- NH3+H2O⟶NH4++OH−{\displaystyle {\ce {NH3 + H2O -> NH4+ + OH-}}}, Ko=1,8⋅10−5.
Взаимодействуя с кислотами, даёт соответствующие соли аммония:
-
- NH3+HNO3⟶NH4NO3{\displaystyle {\ce {NH3 + HNO3 -> NH4NO3}}}.
Аммиак также способен образовывать с металлами соли — амиды, имиды и нитриды. Соединения, содержащие ионы NH2−{\displaystyle {\ce {NH2-}}}, называются амидами, NH2−{\displaystyle {\ce {NH^{2-}}}} — имидами, а N3−{\displaystyle {\ce {N^{3-}}}} — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
-
- 2NH3+2K⟶2KNH2+H2↑{\displaystyle {\ce {2NH3 + 2K -> 2KNH2 + H2 ^}}}.
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы OH−{\displaystyle {\ce {OH-}}} и NH2−{\displaystyle {\ce {NH2-}}}, а также молекулы H2O{\displaystyle {\ce {H2O}}} и NH3{\displaystyle {\ce {NH3}}} изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
-
- NaNH2+H2O⟶NaOH+NH3↑{\displaystyle {\ce {NaNH2 + H2O -> NaOH + NH3 ^}}}.
и в спиртах:
-
- KNH2+C2H5OH⟶C2H5OK+NH3↑{\displaystyle {\ce {KNH2 + C2H5OH -> C2H5OK + NH3 ^}}}.
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
-
- KNH2⇄K++NH2−{\displaystyle {\ce {KNH2\rightleftarrows {K+}+NH2-}}}.
Фенолфталеин в этих растворах окрашивается в малиновый цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2{\displaystyle {\ce {LiNH2}}} — нерастворим, NaNH2{\displaystyle {\ce {NaNH2}}} — малорастворим, KNH2{\displaystyle {\ce {KNH2}}}, RbNH2{\displaystyle {\ce {RbNH2}}} и CsNH2{\displaystyle {\ce {CsNH2}}} — хорошо растворимы.
При нагревании аммиак разлагается, проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
-
- 2NH3→1200—1300 ∘CN2+3H2{\displaystyle {\ce {2NH3->{N2}+3H2}}} (реакция обратима),
- 4NH3+3O2⟶2N2↑+6H2O{\displaystyle {\ce {4NH3 + 3O2 -> 2N2 ^ + 6H2O}}} (без катализатора, при повышенной температуре),
- 4NH3+5O2⟶4NO↑+6H2O{\displaystyle {\ce {4NH3 + 5O2 -> 4NO ^ + 6H2O}}} (в присутствии катализатора, при повышенной температуре).
На восстановительной способности NH3{\displaystyle {\ce {NH3}}} основано применение нашатыря NH4Cl{\displaystyle {\ce {NH4Cl}}} для очистки поверхности металла от оксидов при их пайке:
-
- 3CuO+2NH4Cl⟶3Cu+3H2O+2HCl+N2{\displaystyle {\ce {3CuO + 2NH4Cl -> 3Cu + 3H2O + 2HCl + N_2}}}.
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
-
- 2NH3+NaOCl⟶N2H4+NaCl+H2O{\displaystyle {\ce {2NH3 + NaOCl -> N2H4 + NaCl + H2O}}}.
Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
-
- NH3+CH3Cl⟶CH3NH3Cl{\displaystyle {\ce {NH3 + CH3Cl -> Cl}}} (гидрохлорид метиламмония).
С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
При 1000 °C аммиак реагирует с углём, образуя синильную кислоту HCN{\displaystyle {\ce {HCN}}} и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
-
- 2CH4+2NH3+3O2⟶2HCN↑+6H2O{\displaystyle {\ce {2CH4 + 2NH3 + 3O2 -> 2HCN ^ + 6H2O}}},
C солями меди и с серебром образует комплексные соли-аммиакаты
-
- Cu(NO3)2+4NH3⟶Cu(NH3)4(NO3)2{\displaystyle {\ce {Cu(NO3)2 + 4NH3 -> (NO3)2}}},
- Cu3(PO4)2+12NH3⟶Cu(NH3)43(PO4)2{\displaystyle {\ce {Cu3(PO4)2 + 12NH3 -> 3(PO4)2}}},
- Cu(CH3COO)2+4NH3⟶Cu(NH3)4(CH3COO)2{\displaystyle {\ce {Cu(CH3COO)2 + 4NH3 -> (CH3COO)2}}},
- AgNO3+2NH3⟶Ag(NH3)2NO3{\displaystyle {\ce {AgNO3 + 2NH3 -> NO3}}}.
Колонна синтеза аммиака, построенная в 1921 году BASF в Оппау, ныне расположена при университете Карлсруэ.
Аммиак в медицине[править | править код]
При укусах насекомых аммиак применяют наружно в виде примочек. 10 % водный раствор аммиака известен как нашатырный спирт.
Возможны побочные действия: при продолжительной экспозиции (ингаляционное применение) аммиак может вызвать рефлекторную остановку дыхания.
Местное применение противопоказано при дерматитах, экземах, других кожных заболеваниях, а также при открытых травматических повреждениях кожных покровов.
При случайном поражении аммиаком слизистой оболочки глаза промыть глаза водой (по 15 раз через каждые 10 мин) или 5 % раствором борной кислоты, не растирая глаза. Масла и мази не применяют. При поражении носа и глотки — 0,5 % раствор лимонной кислоты или натуральные соки. В случае приёма внутрь пить воду, фруктовый сок, молоко, лучше — 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка.
Взаимодействие с другими лекарственными средствами малоизучено.
Происхождение названия
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрёстке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали минерал нашатырь (NH4Cl), который при нагревании испаряет аммиак.
